Константа растворимости. Растворимость.
В системе, состоящей из раствора и осадка, идут два процесса - растворение осадка и осаждение. Равенство скоростей этих двух процессов является условием равновесия.
Насыщенный раствор - это раствор, который находится в равновесии с осадком.
Применим закон действия масс к равновесию между осадком и раствором.
AgCl(тв.)  Ag+ + Cl-
Ag+ + Cl-
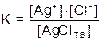 Поскольку [AgClтв] = const, имеем:
Поскольку [AgClтв] = const, имеем:
К×[AgClтв] = KSAgCl =[Ag+]×[Cl-] В общем виде имеем:
AmBn(тв.)  mA+n + nB-m и KS(AmBn) = [A+n]m×[B-m]n.
mA+n + nB-m и KS(AmBn) = [A+n]m×[B-m]n.
Константа растворимости KS (или произведение растворимости ПР) - произведение концентраций ионов в насыщенном растворе малорастворимого электролита - есть величина постоянная и зависит лишь от температуры.
Примеры величин KS для ряда солей:
KS(AgCl) = 1,6×10-10
KS(Ag2CrO4) = 1,1×10-12
KS(Ag2S) = 6×10-50.
Растворимостьмалорастворимого вещества s может быть выражена в молях на литр. В зависимости от величины s вещества могут быть разделены на малорастворимые - s < 10-4 моль/л, среднерастворимые - 10-4 моль/л £ s £ 10-2 моль/л и хорошо растворимые s >10-2 моль/л.
Растворимость соединений связана с их константой растворимости. Для AgCl имеем:
AgCl(тв.)  Ag+ + Cl-
Ag+ + Cl-
s s s
Растворимость s - молярная концентрация AgCl в растворе:
s = [AgClр-р] = m/(M´V) [AgClр-р] = s = [Ag+] = [Cl-].
Отсюда KS AgCl = [Ag+]×[Cl-] = s2 и s= 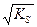 .
.
В общем виде для AmBn имеем: AmBn(тв.)  mA+n + nB-m
mA+n + nB-m
s ms ns
KS(AmBn) = [A+n]m×[B-m]n = (ms)m(ns)n = mmnnsm+n.
Пример. Найти растворимость AgCl (KS=1,6×10-10) и Ag2CrO4 (KS= 1,2×10-12).
Решение. AgCl  Ag+ + Cl- ,
Ag+ + Cl- ,
KS = s2, s = 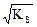 = 1,34×10-5 моль/л.
= 1,34×10-5 моль/л.
Ag2CrO4  2Ag+ + CrO42-
2Ag+ + CrO42-
s 2s s
KS = (2s)2×s = 4s3, s = 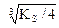 = 6,5×10-5 моль/л.
= 6,5×10-5 моль/л.
Хотя обычно растворимость тем меньше, чем меньше KS, в данном случае для соединений разных типов s(AgCl) < s(Ag2CrO4), хотя KS(AgCl) > KS(Ag2CrO4).
Дата добавления: 2015-09-07; просмотров: 1174;
