Константа диссоциации
В растворах слабых электролитов процесс диссоциации протекает обратимо и, следовательно к нему можно применить закон действующих масс и записать константу равновесия слабого электролита, она называется константа диссоциации:

КД зависит от природы электролита и растворителя, от температуры и не зависит от концентрации раствора. Чем выше КД, тем легче электролит диссоциирует.
Многоосновные кислоты диссоциируют ступенчато:
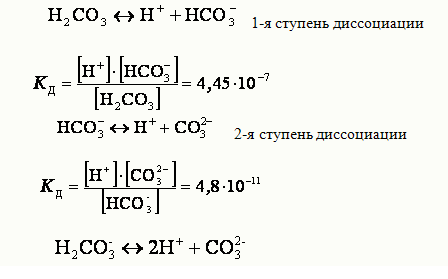
Суммарному равновесию отвечает суммарная константа диссоциации КД
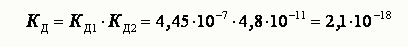
При ступенчатой диссоциации веществ распад по последующей ступени всегда происходит в мень-шей степени, чем по предыдущей. Соблюдается неравенство: КД1> КД2 > КД3…. Это объясняется тем, что энергия необходимая для отрыва иона от нейтральной молекулы меньше, чем при диссоциации по каждой следующей ступени.
Ионное произведение воды Изучение очищенной от примесей воды показало, что она обладает электропроводностью, повы-шающейся с ростом температуры. Это можно объяснить небольшой самодиссоциацией воды на ионы водорода и гидроксид-ионы (автопротолизом):
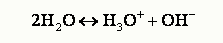
По величине электрической проводимости чистой воды можно вычислить концентрацию ио-нов гидроксония Н3О+ и гидроксид-ионов в воде. При 25º С она равна 10‾7 моль/л. Константа диссоциации воды может быть вычислена по уравнению
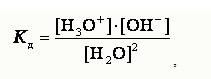
Перепишем это уравнение следующим образом:
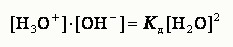
Поскольку степень диссоциации воды очень мала, то концентрация недиссоциированных моле-кул Н2О в воде равна общей концентрации воды.
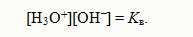
Полученное уравнение показывает, что для воды и разбавленных водных растворов при неизменной температуре произведение концентраций ионов гидроксония и гидроксид-ионов есть величина по-стоянная. Она называется ионным произведением воды. Численное ее значение можно получить, если подставить концентрации ио-нов гидроксония и гидроксид-ионов. В чистой воде при 25ºС [H3O+] = [OH‾] = 1•10‾7 моль/л. Поэтому для указанной температуры:
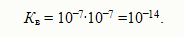
Диссоциацию воды часто записывают в более простом виде:
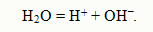
Кв – не зависит от концентрации ионов Н+ и ОНˉ. Так, если в воду добавить кислоты, концентрация ионов Н+ резко возрастет. Тогда за счет подавления диссоциации воды равновесие этого процесса сместится влево и концентрация ионов ОНˉ уменьшится, но ионное произведение воды останется неизменным. Водородный показатель рН В соответствии теорией электролитической диссоциации ионы Н+ являются носителями кислотных свойств, а ионы ОНˉ - носителями основных свойств.раствор будет нейтральным, когда
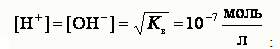
кислым, когда
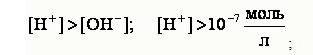
и щелочным, когда
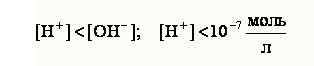
Для характеристики кислотности (щелочности) среды введен специальный параметр – водородный показатель, или pH. Водородным показателем, или pH, называется взятый с обратным знаком десятичный логарифм концентрации водородных ионов в растворе:
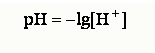
Из ионного произведения следует:
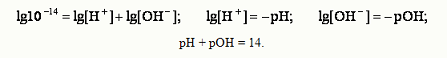
Таким образом, зная рОН , можно легко рассчитать рН, и наоборот, по известному значе-нию рН легко определяется рОН. Величина рН может служить критерием силы кислоты или основания. В ряду кислот наиболее силь-ной будет та, у которой при одинаковой молярной концентрации, концентрация ионов Н+ выше (рН ниже). Водородный показатель имеет важное значение для жизнедеятельности организма, так в нор-ме рН сыворотки крови равен 7,40, слюны – 6,35 - 6,85, желудочного сока 0,9 – 1,1.Отклонение рН от нормальных значений приводит к расстройству деятельности организма.
Буферные растворы
Растворы, рН которых относительно мало изменяется при добавлении небольших количеств ки-слоты или основания, называются буферными. Они обычно содержат слабую кислоту и ее соль, например СН3СООН + СН3СООNa или слабое ос-нование и его соль, например, NH4OH + NH4Cl. В растворе кислота и соль диссоциируют:
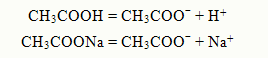
При добавлении кислоты в раствор ионы водорода связываются в слабую кислоту
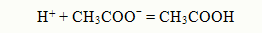
При добавлении основания в раствор ОНˉ ионы связываются в слабый электролит Н2О
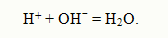
Образование слабых электролитов при добавлении в буферные растворы кислоты или основания и обусловливает устойчивость рН.
Вопросы и задания для самоподготовки:
1.Что такое сольваты, сольватация?
2.Что такое гидраты, гидратация?
3.Перечислить основные положения теории электролитической диссоциации С.Аррениуса.
4.Степень диссоциации, как показатель силы электролитов.
5.Что такое ионное произведение воды?
6.Понятие водородного показателя, его роль в определении среды растворов
Дата добавления: 2015-11-10; просмотров: 5664;
