Кинетика односторонних реакций различного порядка
Элементарными (одностадийными) называются реакции, осуществление которых связано с преодолением одного энергетического барьера при переходе из одного состояния реакционной системы в другое. Механизм такой реакции соответствует ее стехиометрическому уравнению. Кинетическое уравнение необратимой элементарной реакции
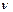 А А +
А А + 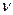 В В
В В 
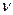 С С +
С С + 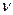 Р Р
Р Р
в соответствии с первым постулатом, основанном на законе действующих масс, имеет вид
Wi = k C 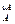 С
С 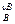 ∙ … ∙С
∙ … ∙С 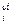

 (3.9)
(3.9)
где k- константа скорости реакции; 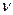 А,
А, 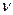 В,
В, 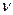 I – частный порядок реакции по i компоненту; СА, СВ, Сi – концентрации i -го вещества.
I – частный порядок реакции по i компоненту; СА, СВ, Сi – концентрации i -го вещества.
Под термином «частный порядок реакции» понимают показатель степени, в которой концентрация i -го вещества входит в кинетическое уравнение. Сумма частных порядков составляет общий порядок реакции 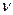 , определяющий вид кинетического уравнения и размерность константы скорости:
, определяющий вид кинетического уравнения и размерность константы скорости:
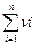 =
= 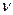 (3.10)
(3.10)
Для элементарных реакций частные порядки (порядки реакций по отдельным реагентам) равны соответствующим стехиометрическим коэффициентам в уравнении реакции.
Наряду с понятием «порядок реакции» в химической кинетике используют понятие «молекулярность». Молекулярность реакции равна минимальному числу молекул, одновременно принимающих участие в одном элементарном акте реакции.
Для элементарных реакций порядок равен молекулярности и может иметь значения 1, 2, 3. Порядок (или молекулярность) элементарных реакций не превышает значения 3, так как вероятность одновременного столкновения более чем трех молекул чрезвычайно низка. Большинство элементарных реакций – это реакции второго порядка.
Сопоставив уравнения (3.2) и (3.9) получаем дифференциальное уравнение скорости
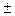
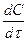 i = k C
i = k C 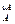 С
С 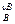 ∙ … ∙С
∙ … ∙С 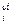 .
. 
 (3.11)
(3.11)
Скорость реакции можно определить по каждому из компонентов; знак ее зависит от знака стехиометрического коэффициента этого компонента ( 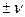 I ).
I ).
В общем виде
W = Wi / 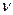 i, (3.12)
i, (3.12)
где 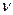 I – стехиометрический коэффициент i –го компонента.
I – стехиометрический коэффициент i –го компонента.
Скорость реакции, как правило, определяется по одному из компонентов, наиболее легко определяемому при проведении эксперимента.
Уравнение (3.12) действительно для простых (элементарных) реакций.
Из кинетических уравнений следует, что скорость простой реакции пропорциональна концентрациям веществ, являющихся реагентами в данной реакции. Следовательно, для простых реакций увеличение концентрации исходных веществ практически всегда приводит к увеличению скорости (за исключением реакций нулевого порядка, скорость которых не зависит от концентрации).
Если приведенная выше реакция характеризуется различающимися частными порядками по компонентам А и В, то наибольшее влияние на скорость реакции будет оказывать изменение концентрации реагента, имеющего больший частный порядок. Например, если кинетическое уравнение реакции, в котором участвуют два реагента, имеет вид
W = k C 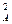 C
C 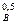 ,
,
то увеличение концентрации реагента А в два раза вызовет рост скорости в четыре раза (22), а двукратное увеличения концентрации реагента В приведет к увеличению скорости лишь в 1,4 раза ( 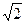 ).
).
Дата добавления: 2017-11-04; просмотров: 1203;
