КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
Данный раздел энзимологии изучает влияние различных факторов на скорость ферментативной реакции. Учитывая общее уравнение ферментативного катализа обратимой реакции превращения одного субстрата в один продукт (1),
 (1)
(1)
следует назвать главные факторы влияния на скорость ферментативной реакции: концентрация субстрата [S], концентрация фермента [E] и концентрация продукта реакции [P].
Взаимодействие некоторых ферментов с их субстратом можно описать гиперболической кривой зависимости скорости ферментативной реакции V от концентрации субстрата [S] (рис.19):

Рис.19.Зависимость скорости ферментативной реакции от концентрации субстрата.
На этой кривой можно выделить три участка, которые можно объяснить по положениям механизма взаимодействия фермента с субстратом: ОА – участок прямо пропорциональной зависимости V от [S], происходит постепенное заполнение активных центров фермента молекулами субстрата с образованием неустойчивого комплекса ES; участок АВ - криволинейная зависимость V от [S], полное насыщение активных центров фермента молекулами субстрата еще не достигнуто. Комплекс ES до достижения переходного состояния является нестабильным, вероятность обратной диссоциации до E и S еще велика; участок ВС - зависимость описывается уравнением нулевого порядка, участок параллелен оси [S], достигнуто полное насыщение активных ферментов молекулами субстрата, V=Vmax.
Характерная форма кривой описывается математически уравнением Бриггса-Холдейна:
V=Vmax ● [S]/ Km + [S] (2),
где Кm - константа Михаэлиса-Ментен, численно равная концентрации субстрата, при которой скорость ферментативной реакции равна половине Vmax.
Чем меньше Km фермента, тем выше сродство фермента к субстрату, тем быстрее достигается переходное состояние для субстрата, и он превращается в продукт реакции. Поиск значений Km для каждого из субстратов фермента с групповой специфичностью важен при определении биологической роли этого фермента в клетке.
Для большинства ферментов невозможно построить гиперболическую кривую (рис.19), В таком случае используется метод двойных обратных величин (Лайнуивера-Бэрка), т.е. строится графическая зависимость 1/[V] от 1/[S] (рис.20). Метод построения таких кривых в эксперименте очень удобен при изучении влияния различных типов ингибиторов на активность ферментов (см. по тексту дальше).

Рис.20. График зависимости 1/[V] от 1/[S] (метод Лайнуивера-Бэрка),
где y-отсекаемый участок - 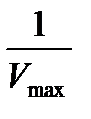 , а x – отсекаемый участок -
, а x – отсекаемый участок - 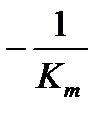 , тангенс угла α -
, тангенс угла α - 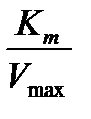 .
.
Зависимость скорости ферментативной реакции V от концентрации фермента [E].
Данная графическая зависимость (рис.21) рассматривается при оптимальных температуре и рН окружающей среды, при концентрациях субстрата, значительно превышающих концентрацию насыщения активных центров фермента.

Рис. 21. Влияние концентрации фермента на скорость ферментативной реакции.
Зависимость скорости ферментативной реакции от концентрации кофактора или кофермента. Для сложных ферментов, следует учитывать, что дефицит коферментных форм витаминов при гиповитаминозах, нарушение поступления в организм ионов металлов обязательно приводят к уменьшению концентрации соответствующих ферментов, необходимых для течения процессов обмена веществ. Поэтому следует сделать вывод о прямой зависимости активности фермента от концентрации кофактора или кофермента.
Влияние концентрации продуктов на скорость ферментативной реакции. Для обратимых реакций, протекающих в организме человека, необходимо учитывать, что продукты прямой реакции могут быть использованы ферментом в качестве субстратов обратной реакции. Поэтому направление течения и момент достижения Vmax являются зависимыми от соотношения концентраций исходных субстратов и продуктов реакции. Так, например, активность аланинаминотрасферазы, катализирующей превращение:
Аланин + Альфа-кетоглутарат ↔ Пируват + Глутамат
зависит в клетке от соотношения концентраций:
[аланин + альфа-кетоглутарат] / [пируват+глутамат].
МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ. ТЕОРИИ ФЕРМЕНТАТИВНОГО КАТАЛИЗА
Ферменты, как и небелковые катализаторы, увеличивают скорость химической реакции по причине способности снижать энергию активации этой реакции. Энергия активации ферментативной реакции рассчитывается как разность между значением энергии в системе протекающей реакции достигшей переходного состояния и энергией, определяемой в начале реакции (см. графическую зависимость рис. 22).

Рис. 22. Графическая зависимость энергетического состояния химической реакции без фермента (1) и в присутствии фермента (2) от времени течения реакции.
Работы В. Генри и, в особенности, Л. Михаэлиса, М. Ментен по изучению механизма моносубстратных обратимых ферментативных реакций позволили постулировать, что фермент Е сначала обратимо и относительно быстро соединяется со своим субстратом S c образованием фермент-субстратного комплекса (ЕS):
E + S <=> ES (1)
Образование ЕS происходит за счет водородных связей, электростатических, гидрофобных взаимодействий, в некоторых случаях ковалентных, координационных связей между боковыми радикалами аминокислотных остатков активного центра и функциональными группами субстрата. У сложных ферментов функцию контакта с субстратом может выполнить и небелковая часть структуры.
Фермент-субстратный комплекс затем распадается во второй более медленной обратимой реакции с образованием продукта реакции Р и свободного фермента Е:
ES <=> EР <=>E + P (2)
В настоящее время, благодаря работам выше названных ученых, а также Кейлина Д., Чанса Б., Кошленда Д. (теория «индуцированного соответствия»), существуют теоретические положения о четырёх основных моментах в механизме действия фермента на субстрат, определяющих способность ферментов ускорять химические реакции:
1. Ориентация и сближение. Фермент способен связывать молекулу субстрата таким образом, что атакуемая ферментом связь оказывается не только расположенной в непосредственной близости от каталитической группы, но и правильно ориентированной по отношению к ней. Вероятность того, что комплекс ES достигнет переходного состояния за счет ориентации и сближения, сильно увеличивается.
2. Напряжение и деформация: индуцированное соответствие. Присоединение субстрата может вызывать конформационные изменения в молекуле фермента, которые приводят к напряжению структуры активного центра, а также несколько деформируют связанный субстрат, облегчая тем самым достижение комплексом ES переходного состояния. Возникает так называемое индуцированное соответствие между молекулами E и S.
3. Общий кислотно-основной катализ. В активном центре фермента всегда присутствуют группы специфических аминокислотных остатков, которые являются хорошими донорами и акцепторами протонов. Эти группы являются мощными катализаторами многих органических реакций, протекающих в водной фазе:
ГРУППЫ
ДОНОРНЫЕ: АКЦЕПТОРНЫЕ:
-СООН -СОО-
-NH -NH2
-SH -S-
4. Ковалентный катализ. В некоторых ферментативных реакциях фермент Е замещает функциональную группу R в субстрате R-X, в результате чего образуется ковалентный комплекс E-X. Комплекс не стабилен и подвержен гидролизу значительно быстрее, чем R-X. Примером такого фермента является химотрипсин. Катализируемая им реакция:
RX + E-OH --> R-OH + EX
EX + H O --> E-OH + HX
Суммарное уравнение: RX + H O --> R-OH + HX (3)
Дата добавления: 2017-09-19; просмотров: 1296;
