Исходные данные к задаче 1.33
| Первая цифра варианта | ||||||||||
| Наименование газа | Аммиак К=1,29 | Двуокись Углерода К=1,3 | Воздух К=1,4 | Азот К=1,4 | Окись углерода К=1,4 | Воздух К=1,4 | Водород К=1,4 | Метан К=1,31 | Метан К=1,31 | Аммиак К=1,29 |
| m, кг | ||||||||||
| ε = V2 / V1 |
Таблица 10
Исходные данные к задаче 1.33
| Вторая цифра варианта | ||||||||||
| t1, 0С | ||||||||||
| P1, МПа | 1,5 | 2,5 | 1,4 | 1,5 | 1,2 | 1,8 | ||||
| N | 1,1 | 1,2 | 1,25 | 1,35 | 1,6 | 1,15 | 1,27 | 1,2 | 1,15 | 1,1 |
Задача 1.34. Поршневой одноступенчатый компрессор простого действия засасывает V, м3 газа при начальных параметрах Р1 и t1 и сжимает его изотермически, адиабатно и политропно с показателем «n». Степень повышения давления ε = Р2 / Р1.
Определить: 1) теоретическую работу сжатия газа и мощность компрессора; 2) количество теплоты, отводимой от газа в процессе сжатия; 3) температуру газа в конце сжатия. Изобразить совмещенную (для всех процессов) индикаторную диаграмму компрессора.
Таблица 11
Исходные данные к задаче 1.34
| Первая цифра варианта | ||||||||||
| Наименование газа | Аммиак | Двуокись углерода | Воздух | Азот | кислород | Двуокись углерода | Водород | Метан | Азот | Воздух |
| Р1, МПа | 0,12 | 0,106 | 0,11 | 0,12 | 0,1 | 0,15 | 0,1 | 0,11 | 0,105 | 0,1 |
| t1, 0С | ||||||||||
| n | 1,1 | 1,2 | 1,15 | 1,6 | 1,5 | 1,25 | 1,2 | 1,6 | 1,1 | 1,25 |
Таблица 12
Исходные данные к задаче 1.34
| Вторая цифра варианта | ||||||||||
| V, м3/ч | ||||||||||
| ε = Р2 / Р1 |
Расчет газового цикла.
Сухой воздух массой 1кг совершает прямой цикл, состоящий из четырех термодинамических процессов. Задан вид каждого из процессов и значения некоторых параметров состояния рабочего тела.
Требуется:
1. Рассчитать давление, удельный объем, температуру для основных точек цикла.
2. Для каждого из процессов определить значения показателей политропы n, теплоемкости с, вычислить изменение внутренней энергии ΔU, энтальпии Δh, энтропии Δs, теплоту q и работу l процесса.
3. Определить суммарные количества подведенной и отведенной теплоты, работу цикла и термический КПД.
4. Построить цикл в Pυ- и TS- диаграммах состояния.
Принять газовую постоянную воздуха R = 287 Дж/(кг∙К), теплоемкость Ср = 1,025 кДж/(кг∙К).
Исходные данные для расчета приведены в таблице13
Таблица 13
Исходные данные для расчета газового цикла
| Заданные параметры в основных точках Р, МПа; V, м3/кг; Т, К | Тип процесса и показатель политропы | ||||||||
| 1-2 | 2-3 | 3-4 | 4-1 | ήt | |||||
| P1=0,8 | υ1=0,12 | P2=2,0 | P3=1,2 | S=c | T=c | S=c | υ=c | 14,0 | |
| P1= 1,3 | T1=573 | P2=0,5 | T3=290 | T=c | S=c | T=c | S=c | 49,0 | |
| P1=0,2 | υ1=0,45 | P2=1,2 | T3=573 | S=c | υ=c | S=c | P=c | 42,0 | |
| P1=35 | T1=483 | T2=573 | P3=25 | P=c | N=c | P=c | υ=c | 5,4 | |
| P1=0,1 | T1=273 | P2=0,5 | T3=473 | n=1,3 | P=c | n=c | P=c | 25,0 | |
| P1=0,09 | T1=303 | P2=0,4 | T3=473 | n=1,2 | P=c | n=c | υ=c | 19,2 | |
| P1=0,16 | υ1=0,5 | T2=423 | P3=2,5 | n=1,2 | υ=c | n=c | P=c | 16,5 | |
| P1=0,18 | υ1=303 | υ2=0,1 | P3=0,3 | n=1,1 | T=c | n=c | υ=c | 5,2 | |
| P1=0,3 | υ1=0,3 | P2=2,0 | T3=573 | n=1,3 | P=c | n=c | P=c | 27,3 | |
| P1=2,0 | T1=473 | T2=623 | υ3=0,12 | P=c | S=c | υ=c | T=c | 10,0 | |
| P1=0,2 | T1=323 | P2=2,0 | υ3=473 | T=c | P=c | T=c | P=c | 21,5 | |
| P1=0,4 | T1=373 | P2=1,6 | P3=0,6 | S=c | T=c | S=c | P=c | 19,4 | |
| P1=0,3 | T1=300 | P2=0,8 | T3=473 | T=c | υ=c | T=c | υ=c | 19,2 | |
| P1=1,2 | T1=373 | P2=3,0 | T3=473 | T=c | P=c | T=c | P=c | 11,6 | |
| P1=5,0 | T1=573 | P2=1,8 | υ3=0,2 | T=c | S=c | Υ=c | S=c | 38,6 | |
| P1=0,7 | υ1=0,12 | P2=2,0 | T3=473 | S=c | P=c | S=c | T=c | 33,0 | |
| P1=0,3 | T1=303 | P2=0,6 | T3=523 | S=c | υ=c | S=c | T=c | 32,6 | |
| P1=0,12 | υ1=0,7 | υ2=0,2 | T3=423 | T=c | P=c | T=c | P=c | 16,9 | |
| P10,4 | υ1=0,3 | P2=1,0 | T3=573 | T=c | P=c | S=c | P=c | 15,6 | |
| P1=0,7 | T1=473 | T2=573 | V3=0,4 | P=c | T=c | Υ=c | S=c | 15,7 | |
| P1=0,3 | T1=298 | P2=1,0 | T3=573 | S=c | P=c | T=c | P=c | 20,0 | |
| P1=0,3 | υ1=0,3 | P2=1,0 | T3=473 | S=c | υ=c | T=c | P=c | 18,0 | |
| P1=1,0 | T1=523 | T2=573 | P3=0,6 | P=c | S=c | P=c | υ=c | 7,8 | |
| P1=1,2 | υ1=0,08 | P2=1,4 | T3=423 | υ=c | P=c | Υ=c | P=c | 1,1 | |
| P1=0,12 | T1=323 | P2=2,5 | T3=573 | S=c | P=c | T=c | P=c | 19,4 | |
| P1=0,12 | T1=283 | P2=0,8 | T3=573 | S=c | P=c | S=c | P=c | 41,7 | |
| P1=0,08 | T1=293 | υ2=0,4 | T3=573 | T=c | υ=c | S=c | υ=c | 26,2 | |
| P1=1,2 | T1=383 | P2=6,0 | T3=593 | S=c | P=c | S=c | υ=c | 36,7 | |
| P1=0,1 | T1=338 | T2=2731 | T3=433 | n=1,3 | P=c | S=c | υ=c | 32,5 | |
| P1=0,3 | T1=239 | P2=1,8 | T3=603 | S=c | υ=c | S=c | υ=c | 41,5 |
Типы процессов: Р=с – изобарный; Т=с – изотермический; S=c – адиабатный; υ =c – изохорный; для политропных процессов задано значение показателя политропы «n».
РЕАЛЬНЫЕ ГАЗЫ
Реальные газы отличаются от идеальных газов тем, что молекулы этих газов имеют конечные собственные объемы и связаны между собой силами взаимодействия, имеющими электромагнитную и квантовую природу. Эти силы существуют между любыми молекулами при любых условиях и уменьшаются с увеличением расстояния между молекулами. При сближении молекул на малые расстояния силы притяжения резко уменьшаются и переходят в силы отталкивания, достигающие очень больших значений.
Из-за наличия сил взаимодействия между молекулами и конечности их объема законы идеальных газов ни при каких условиях не могут быть строго применимы к реальным газам.
При практических расчетах различных свойств реальных газов нашло широкое применение отношение р∙υ/R∙T = C, которое получило название коэффициента сжимаемости. Этот коэффициент отражает отклонение свойств реального газа от свойств идеального. Значение С для реальных газов в зависимости от давления и температуры может быть больше и меньше единицы, и только при очень малых давлениях и высоких температурах оно практически равно единице. На рис.5 показана зависимость С от давления при температуре t=0оС для некоторых газов.
Свойства реальных газов как в количественном, так и в качественном отношениях значительно отличаются от свойств идеальных газов. Поэтому все результаты, полученные для реальных газов на основе законов идеальных газов, нужно рассматривать как приближенные.
Отличие свойств любого реального газа от свойств идеального заставило ученых разрабатывать новые уравнения состояния, которые связывали бы значения р, υ и T и давали бы возможность рассчитывать некоторые свойства газов для разных условий, не прибегая к дорогостоящим, не всегда доступным прямым измерениям.
Наиболее простым и качественно верно отражающим поведение реального газа является уравнение Ван-дер-Ваальса.
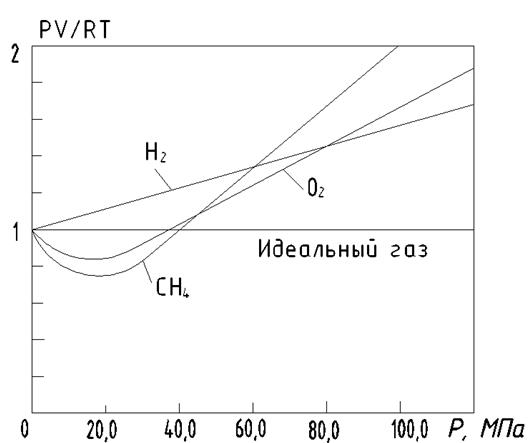
Рис.5. Зависимость С от давления при температуре t=0оС для некоторых газов.
Свойства реальных газов как в количественном, так и в качественном отношениях значительно отличаются от свойств идеальных газов. Поэтому все результаты, полученные для реальных газов на основе законов идеальных газов, нужно рассматривать как приближенные.
Отличие свойств любого реального газа от свойств идеального заставило ученых разрабатывать новые уравнения состояния, которые связывали бы значения р, υ и T и давали бы возможность рассчитывать некоторые свойства газов для разных условий, не прибегая к дорогостоящим, не всегда доступным прямым измерениям.
Наиболее простым и качественно верно отражающим поведение реального газа является уравнение Ван-дер-Ваальса.
Дата добавления: 2017-04-20; просмотров: 1266;
