Метод полуреакций, или электронно-ионный метод
Как показывает само название, этот метод основан на составлении ионных уравнений из процесса окисления и процесса восстановления с последующим суммированием их в общее уравнение. В качестве примера составим уравнение той же реакции, которую использовали для объяснения метода электронного баланса (пример 3). При пропускании сероводорода H2S через подкисленный раствор перманганата калия KMnO4, малиновая окраска исчезает и раствор мутнеет. Опыт показывает, что помутнение раствора происходит в результате образования элементной серы, т.е. протекания процесса:
H2S®S+2H+
Эта схема уравнена по числу атомов. Для уравнивания по числу зарядов надо от левой части схемы отнять два электрона, после чего можно стрелку заменить на знак равенства: H2S-2e-=S+2H+
Это первая полуреакция — процесс окисления восстановителя H2S. Обесцвечивание раствора связано с переходом иона MnO4 (он имеет малиновую окраску) в ион Mn2+ (практически бесцветный и лишь при большой концентрации имеет слабо-розовую окраску), что можно выразить схемой:
MnO-4 ®Mn2+
В кислом растворе кислород, входящий в состав ионов MnO-4, вместе с ионами водорода в конечном итоге образует воду. Поэтому процесс перехода записываем так:
MnO-4+8Н+®Mn2++4Н2О
Чтобы стрелку заменить на знак равенства, надо уравнять и заряды. Поскольку исходные вещества имеют семь положительных зарядов (7+), а конечные — два положительных (2+), то для выполнения условия сохранения зарядов надо к левой части схемы прибавить пять электронов:
MnO-4+8Н++5е-=Mn2++4Н2O
Это вторая полуреакция — процесс восстановления окислителя, т.е. перманганат-иона MnO-4.
Для составления общего уравнения реакции надо уравнения полуреакций почленно сложить, предварительно уравняв числа отданных и полученных электронов. В этом случае по правилам нахождения наименьшего кратного определяют соответствующие множители, на которые умножаются уравнения полуреакций. Сокращенно запись проводится так:
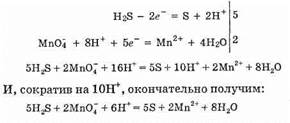
Проверяем правильность составления в ионной форме уравнения: число атомов кислорода в левой части 8, в правой 8; числе зарядов: в левой части (2-)+(6+)=4+, в правой 2(2+) = 4+. Уравнение составлено правильно, так как атомы и заряды уравнены.
Методом полуреакций составляется уравнение реакции в ионной форме. Чтобы от него перейти к уравнению в молекулярной форме, поступаем так: в левой части ионного уравнения к каждому аниону подбираем соответствующий катион, а к каждому катиону — анион. Затем те же ионы в таком же числе записываем в правую часть уравнения, после чего ионы объединяем в молекулы:
5H2S+2MnO-4+6Н+=5S+2Mn2++8Н2O
2К++3SO2-4=2К++3SO2-4
5H2S+2KMnO4+3H2SO4=5S+2MnSO4+K2SO4+8Н2О
Таким образом, составление уравнений окислительно-восстановительных реакций с помощью метода полуреакций приводит к тому же результату, что и метод электронного баланса.
В качестве примера составления уравнений окислительно-восстановительных реакций рассмотрим процесс окисления пирита концентрированной азотной кислотой:
FеS2+НNO3(конц)®
Прежде всего определим продукты реакции. HNO3 является сильным окислителем, поэтому сера будет окисляться до максимальной степени окисления S6+, а железо — до Fe3+, при этом HNO3 может восстанавливаться до NO или NO2. Выберем NO.
FeS2+НNO3(конц)®Fe(NO3)3+H2SO4+NO
Где будет находиться Н2О (в левой или правой части), мы пока не знаем.
1. Применим сначала метод электронно-ионного баланса. В этом методе рассматривают переход электронов от одних атомов или ионов к другим с учетом характера среды (кислая, щелочная или нейтральная), в которой протекает реакция. При составлении уравнений процессов окисления и восстановления для уравнивания числа атомов водорода и кислорода вводят (в зависимости от среды) или молекулы воды и ионы водорода (если среда кислая), или молекулы воды и гидроксид-ионы (если среда щелочная). Соответственно и в получаемых продуктах в правой части электронно-ионного уравнения будут находиться ионы водорода и молекулы воды (кислая среда) или гидроксид-ионы и молекулы воды (щелочная среда).
Таким образом, при написании электронно-ионных уравнений нужно исходить из состава ионов, действительно имеющихся в растворе. Кроме того, как и при составлении сокращенных ионных уравнений, вещества малодиссоциирующие, плохо растворимые или выделяющиеся в виде газа следует писать в молекулярной форме.
Рассмотрим для нашего случая полуреакцию окисления. Молекула FeS2 превращается в ион Fe3+ (Fe(NO3)3 полностью диссоциирует на ионы, гидролизом пренебрегаем) и два иона SO2-4 (диссоциация H2SO4):
FeS2 ®Fe3++2SO2-4 (1)
Для того чтобы уравнять кислород, в левую часть уравнения добавим 8 молекул Н2О, а в правую — 16 ионов Н+ (среда кислая):
FeS2+8Н2О®Fe3++2SO2-4+16H+
Заряд левой части равен 0, заряд правой +15, поэтому FeS2 должен отдать 15 электронов:
FeS2+8Н2O-15e-® Fe3++2SО2-4+16Н+
Рассмотрим теперь полуреакцию восстановления нитрат-иона:
NO-3®NO
Необходимо отнять у NO-3 2 атома О. Для этого к левой части уравнения добавим 4 иона Н+ (кислая среда), а к правой — 2 молекулы Н2О:
NO-3+4H+®NO+2H2O
Для уравнивания заряда в левой части (заряд +3) добавим 3 электрона:
NO-3+4Н++Зe-®NO+2Н2O Окончательно имеем:

Сократив обе части на 16Н+ и 8Н2О, получим сокращенное ионное уравнение окислительно-восстановительной реакции:
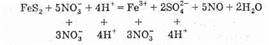
Добавив в обе части уравнения соответствующее количество ионов NO-3 и Н+, находим молекулярное уравнение реакции:
FeS2+8НNO3(конц)=Fe(NO3)3+2H2SO4+5NO+2Н2O
Обратите внимание, что для определения количества отданных и принятых электронов нам ни разу не пришлось определять степень окисления элементов. Кроме того, мы учли влияние среды и автоматически определили, что Н2О находится в правой части уравнения. Несомненно то, что этот метод гораздо больше соответствует химическому смыслу, чем стандартный метод электронного баланса, хотя последний несколько проще для понимания.
2. Уравняем данную реакцию методом электронного баланса. Процесс восстановления описывается просто:
N5++3e-®N2+
Сложнее составить схему окисления, поскольку окисляются два элемента — Fe и S. Можно приписать железу степень окисления 2+, а сере 1" и учесть, что на 1 атом Fe приходятся два атома S:
Fe2+-e-®Fe3+ 2S--14e-®2S6+
Можно, однако, обойтись без определения степени окисления и записать схему, напоминающую схему (1):
FeS2 ®Fe3++2S6+
Правая часть имеет заряд +15, левая — 0, поэтому FeS2 должен отдать 15 электронов. Записываем общий баланс:
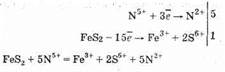
5 молекул HNO3 идут на окисление FeS2, и еще 3 молекулы HNO3 необходимы для образования Fe(NO3)3:
FeS2+8HNO3 ®Fe(NO3)3+2H2SO4+5NO
Чтобы уравнять водород и кислород, добавляем в правую часть 2 молекулы,Н2О:
FeS2+8НNO3(конц)=Fe(NO3)3+2H2SO4+5NO+2Н2О
Сопоставим оба метода. Достоинство метода полуреакций по сравнению с методом электронного баланса в том, что в нем применяются не гипотетические ионы, а реально существующие. При методе полуреакций не нужно знать степень окисления атомов. Написание отдельных ионных уравнений полуреакций необходимо для понимания химических процессов в гальваническом элементе и при электролизе. При этом методе видна роль среды как активного участника всего процесса. Наконец, при использовании метода полуреакций не нужно знать все полученные вещества, они появляются в уравнении реакции при выводе его. Поэтому методу полуреакций следует отдать предпочтение и применять его при составлении уравнений окислительно-восстановительных реакций, протекающих в водных растворах, а также с участием органических соединений, в которых подчас невозможно определить степени окисления элементов.
Приведем пример из области органической химии. Алкены взаимодействуют с нейтральным водным раствором перманганата калия. При этом образуется оксид марганца (IV), а непредельное соединение превращается в вицинальный диол. В качестве соединения с двойной связью возьмем циклогексен:
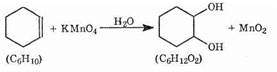
Напишем полуреакции окисления и восстановления:
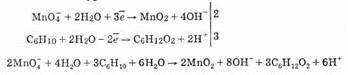
Объединив в правой части суммарного уравнения шесть протонов с шестью гидроксид-ионами, получим шесть молекул воды (вода очень слабый электролит):

Влияние среды на характер протекания реакций
Реакции окисления-восстановления могут протекать в различных средах: в кислой (избыток Н+-ионов), нейтральной (Н2O) и щелочной (избыток гидроксид-ионов OH-). В зависимости от среды может изменяться характер протекания реакции между одними и теми же веществами. Среда влияет на изменение степеней окисления атомов. Так, например, ион MnO-4 в кислой среде восстанавливается до Mn2+, в нейтральной — до MnO2, а в щелочной — до MnO2-4. Схематически эти изменения можно представить так:
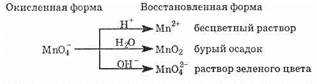
Обычно для создания в растворе кислой среды используют серную кислоту. Азотную и соляную кислоту прибавляют редко: первая сама является окислителем, вторая способна окисляться. Для создания щелочной среды применяются растворы гидроксида калия или натрия.
Руководствуясь приведенной схемой, составим методом полуреакций уравнения реакции взаимодействия сульфита натрия Na2SO3 (восстановитель) с перманганатом калия KMnO4 (окислитель) в различных средах (примеры 1-3).
Пример 1. В кислой среде:

Пероксид водорода в зависимости от среды восстанавливается согласно схеме:
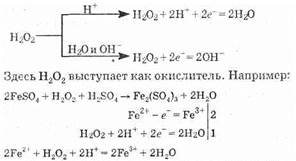
Однако, встречаясь с очень сильным окислителем, как KMnO4, пероксид водорода выступает как восстановитель. Например:
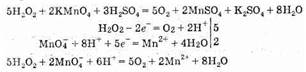
Классификация окислительно-восстановительных реакций
Обычно различают три типа окислительно-восстановительных реакций: межмолекулярные, внутримолекулярные и реакции диспропорционирования.
К межмолекулярным относятся реакции, в которых окислитель и восстановитель находятся в разных веществах. Рассмотренные выше реакции относятся к этому типу. Сюда же следует отнести и реакции между разными веществами, в которых атомы одного и того же элемента имеют различные степени окисления:
2H2S-2+H2S+4O3=2S0+3Н2О
5НСl-1+НСlO+5O3=3Сl02+3Н2О
К внутримолекулярным относятся такие реакции, в которых окислитель и восстановитель находятся в одном и том же веществе. В этом случае атом с более положительной степенью окисления окисляет атом с меньшей степенью окисления. Такими реакциями являются реакции термического разложения. Например:
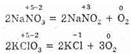
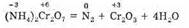
Сюда же следует отнести и разложение веществ, в которых атомы одного и того же элемента имеют разные степени окисления:
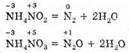
Протекание реакций диспропорционирования сопровождается одновременным увеличением и уменьшением степени окисления атома одного и того же элемента. При этом исходное вещество образует соединения, одно из которых содержит атомы с более высокой, а другое с более низкой степенью окисления. Очевидно, эти реакции возможны для веществ, содержащих атомы с промежуточной степенью окисления. Примером может служить превращение манганата калия K2MnO4, в котором марганец имеет промежуточную степень окисления +6 (в примере между +7 и +4). Раствор этой соли имеет красивый темно-зеленый цвет (цвет иона MnO2-4), однако цвет раствора превращается в бурый. Это выпадает осадок MnO2 и образуется ион MnO-4. Протекает реакция:
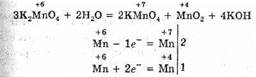
К реакциям диспропорционирования относятся и такие часто встречающиеся реакции, как
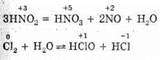
Диспропорция — отсутствие пропорциональности, несоразмерность. Раньше реакции диспропорционирования называли реакциями самоокисления-самовосстановления, сейчас это название почти не употребляется.
Дата добавления: 2016-01-03; просмотров: 4765;
