Феноменологические классификации
Химические реакции и их классификация. Типы разрыва химических
Связей
В общем виде уравнение химической реакции можно записать следующим образом:
а1А1+a2А2+ а3А3 + ...=b1B1+ b2В2+b3В3 +...
Здесь А1, А2, А3, и т.д. называются реагентами (или исходными веществами); В1, В2, В3 и т.д. — продуктами (или конечными веществами), а целые числа а1, а2, а3, b1; b2, b3и т.д. — стехиометрическими коэффициентами.
Химические реакции классифицируются различными Способами. При этом классификации делятся на феноменологические, когда за основу берется некий наблюдаемый параметр, и по механизму реакции.
Феноменологические классификации
1) По виду взаимодействия.
реакции разложения 2H2O2= 2H2O+O2
реакции соединения H2+I2=2HI
реакции замещения Fe+CuCl2 = FeCl2+Cu
реакции двойного обмена Na2SO4+BaCl2=BaSO4+2NaCl
При этом нужно иметь в виду, что многие сложные реакции представляют собой совокупность нескольких одновременно протекающих реакций указанных типов. Так, в реакции
2FeCl3+3Na2S=2FeS¯+ S¯+6NaCl совмещены реакции двойного обмена и разложения.
2) По изменению степеней окисления участвующих в реакции элементов.
Окислительно-восстановительные реакции — те, в которых меняется степень окисления хотя бы одного элемента
2Hg+2O-2=2Hg0 + О02
N-3H4N+3O2=N02+2Н2O
Реакции, идущие без изменения степеней окисления HgO+2НСl=HgCl2+Н2О
3) По полноте протекания процесса.
Необратимые реакции идут практически только в одном направлении, и реагенты полностью превращаются в продукты
2Н2О2 = 2Н2О + О2
Слово практически выделено потому, что истинно необратимых реакций не существует. Мы называем реакцию необратимой, если имеющимися методами не можем заметить обратной реакции.
Обратимые реакции (см. также §14) идут одновременно и в прямом, и в обратном направлении, и реагенты не превращаются полностью в продукты
N2+3H2«2NH3
Для обозначения разницы между обратимыми и необратимыми реакциями в уравнениях используются разные знаки: «=» для необратимых и ««» для обратимых.
4) По тепловому эффекту.
Экзотермические реакции — протекающие с выделением энергии (теплоты)
Р2О5+3Н2О = 2Н3РO4+Q
Эндотермические реакции — протекающие с поглощением энергии (теплоты)
N2+О2=2NO-Q
Химические уравнения, в которых указан знак и величина теплового эффекта реакции, называются термохимическими. Вопросы, связанные с тепловыми эффектами химических реакций, подробно рассмотрены в §11.
В классификации по механизму главную роль играет рассмотрение реальных процессов на молекулярном уровне. Особенно важно такое рассмотрение для понимания органической химии.
В ходе химической реакции разрываются одни связи и образуются другие. При этом разрыв связи может происходить разным способом и вести к разным результатам. Таким образом, выделяются две большие группы реакций — радикальные и ионные.
Радикальные реакции идут с таким разрывом ковалентной связи, при котором из двух электронов, образовывавших связь, один остается у одного фрагмента молекулы, а другой — у другого:
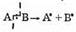
Соответственно, оба фрагмента при этом электронейтральны и имеют неспаренный электрон. Такие частицы называются свободными радикалами, а процесс их образования из стабильной молекулы — гемолитическим разрывом связи (гомо — одинаковый).
Ионные реакции сопровождаются таким разрывом ковалентной связи, при котором оба электрона бывшей связи остаются у одного из фрагментов.
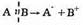
Такого рода процесс называется гетеролитическим разрывом связи (гетеро — разный). Получающиеся при этом частицы заряжены (а стало быть, являются ионами) и называются нуклеофилом и электрофилом.
Нуклеофил (нуклеофильная частица) — это частица, имеющая неподеленную пару электронов. Эта пара электронов может быть использована для образования новой ковалентной связи. Необходимо подчеркнуть, что нуклеофил не обязательно является отрицательным ионом. Так, молекула аммиака (или какого-либо амина) имеет при атоме азота неподеленную электронную пару и является нуклеофилом, будучи электронейтральной.
Электрофил (электрофильная частица) — это частица, имеющая вакантную электронную орбиталь на валентном уровне. При взаимодействии с какой-либо частицей, имеющей пару электронов, электрофил может принять эту пару на свою свободную орбиталь и за счет этого образовать новую связь. Так же как и в случае нуклеофила, электрофил может быть электронейтральной молекулой (например, ВН3).
Разумеется, к органическим реакциям приложима и феноменологическая классификация (так же как к неорганическим — по механизму реакции). Наиболее часто используется классификация по структурному признаку, когда изменения рассматриваются относительно атома (или атомов) углерода, участвующих в реакции. При этом наиболее часто встречаются следующие типы превращений:
присоединение: RCH=CH2+XY®RCHX—CH2Y,
замещение: RCH2X+Y®RCH2Y+X,
отщепление (элиминирование): RCHX—CH2Y ®RCH=CH2+XY,
полимеризация: n(CH2=CH2)®C—CH2—CH2—)n.
В соответствии с вышесказанным, хлорирование метана под действием света классифицируют как радикальное замещение, присоединение галогенов к алкенам — как электрофильное присоединение, а гидролиз алкилгалогенидов — как нуклеофильное замещение. Таким образом, органические реакции можно классифицировать по механизму разрыва связей (ковалентных) в реагирующих молекулах. В зависимости от двух способов ее разрыва и строится данная классификация.
Дата добавления: 2016-01-03; просмотров: 437;
