Структурные составляющие системы железо-углерод
Как было отмечено выше, углерод с железом могут реагировать друг с другом как физически, так и химически. Поэтому в системе Fе - С в зависимости от типа взаимодействия компонентов будут существовать следующие фазы: твердые растворы внедрения, химические соединения и механические смеси, а также чистые компоненты железо и углерод.
Степень растворимости углерода в железе определяется первоначальной структурой кристаллической решетки металла.
Объемноцентрированная кубическая (ОЦК) решетка a-железа имеет пустые места (поры) в середине каждого ребра, их двенадцать. Диаметр его составляет 0,62 Å. Если сравнить данное значение с таковым для углерода (0,77 Å), то можно увидеть, что оно практически недоступно для внедряющегося в железо углерода. Поэтому растворимость данного неметалла в a-железе очень низка. При 727 °С в железе растворяется лишь около 0,02 % углерода. От 1392 до 1499 °С максимальная предельная растворимость углерода составляет 0,1 %. При охлаждении раствора до комнатной температуры данное значение снижается до 0,006 %.
Гранецентрированная кубическая (ГЦК) решетка g-железа в отличие от ОЦК располагает всего одной порой, но с большим диаметром – 1,02 Å. Это позволяет разместиться внедряемому ядру углерода в ней, слегка исказив ее, вызвав небольшое увеличение параметров. При 1147 °С предельная растворимость углерода в g-железе составляет 2,14 %, а при 727 °С лишь 0,8 % (рис. 1.33).
|
|
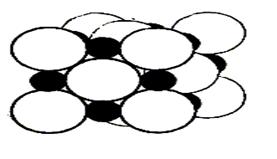
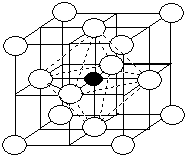
Рис. 1.33 - Схема структуры твердого раствора внедрения: а – при полном заполнении всех пор; б – аустенита
Твердые растворы внедрения углерода и других примесей в a-железе называют ферритом (a), а в g-железе – аустенитом (g). Феррит получил свое название от латинского наименования железа – «Ferrum». Различают низкотемпературный a-феррит с растворимостью углерода до 0,02 % и высокотемпературный d-феррит с предельной растворимостью углерода 0,1 %. Углерод в решетке феррита располагается в центре объема куба. Под микроскопом феррит выявляется в виде однородных полиэдрических зерен. Твердость и механические свойства феррита близки к таковым технически чистого железа (sв = 250 МПа, s0,2 = 120 МПа, d = 50 %, y = 80 %, НВ 80 – 90 кгс/мм2 или 800 – 900 МПа). Они зависят от количества элементов, присутствующих в нем (многие химические элементы образуют с ферритом твердые растворы замещения).
Аустенит был назван так в честь английского ученого Роберта Аустена, который занимался исследованиями структуры составляющих системы железо - углерод и разработкой вариантов ее диаграммы состояния. Углерод в решетке g-железа располагается в центре элементарной ячейки (рис. 1.30, б). Аустенит – парамагнитен, высокопластичен (НВ = 170 – 220 кгс/мм2 или 1700 – 2200 МПа), имеет низкие механические характеристики, такие как пределы текучести и прочности. Микроструктура аустенита - полиэдрические зерна.
Железо и углерод, взаимодействуя друг с другом, могут образовывать ряд металлических карбидов с различными химическими формулами: Fе3С, Fе2С, FеС и другие. Наиболее распространенным и широко применяемым из них является карбид железа среднего состава Fе3С. Стехиометрическое соотношение элементов в нем соответственно равно 3 : 1. Концентрация углерода составляет 6,67 % масс. Кристаллическая решетка карбида железа очень сложная. Она представляет собой орторомбическую структуру с плотной упаковкой структурных единиц (в элементарной ячейке расположено 12 ядерных остовов железа и 4 углерода) и имеет следующие параметры: а = 6,726 Å, b = 5,077 Å, c = 4,515 Å. Характер связи между ядрами железа чисто металлический, а между железом и углеродом ионно-металлический с преобладанием металличности и они оба ведут себя как металлы (рис. 1.34).
Такое строение приводит к тому, что он проявляет металлические признаки: блеск, высокая электропроводность, уменьшающаяся с повышением температуры, легкость образования твердых растворов с металлами. Данное соединение обладает высочайшей твердостью, сравнимой только с алмазом, он легко царапает стекло (НВ более 800 кгс/мм2), но чрезвычайно низкой практически нулевой пластичностью (большой хрупкостью), значительной жаропрочностью и обычно более высокой температурой плавления, чем исходный металл. Эти свойства также являются следствием его особого кристаллического строения. Благодаря своей высокой твердости он был назван цементитом. Из-за его термической и химической неустойчивости температура плавления карбида железа точно не определена в связи с возможностью его распада до чистых элементов: железа и углерода в виде графита. Она принимается примерно равной 1500 °С (1650 °С теоретическая). Однако данный процесс распада имеет важное практическое значение при производстве промышленных чугунов, что будет описано в соответствующих разделах.
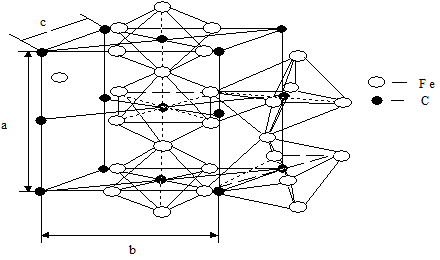
Рис. 1.34 - Кристаллическая структура цементита
Аллотропных видоизменений карбид железа не имеет. До 210 °С цементит ферромагнитен, выше данной температуры он теряет магнитные свойства. Карбид железа способен образовывать твердые растворы замещения, в которых углерод обменивается на такие неметаллы, как азот или кислород, а железо замещается металлами: хромом, вольфрамом, марганцем и другими. Их называют легированными цементитами и описывают брутто-формулой М3С, где буквой М обозначают железо или другие металлы-заместители.
Рассмотренные нами структурные составляющие являются однофазными. В системе железо-углерод наряду с ними при затвердевании сплавов могут формироваться и двухфазные структуры. Это ледебурит и перлит.
Ледебурит - механическая смесь аустенита и цементита (по имени немецкого ученого А. Ледебурга), описывается - g + Fe3C. Он образуется в процессе эвтектического превращения при 1147 °С. Концентрация углерода в нем 4,31 %. По своей структуре он представляет собой чередующиеся пластинки аустенита и цементита. При температурах ниже 727 °С аустенит в этой смеси изотермически трансформируется в перлит. Ледебурит такого состава называется низкотемпературным.
Перлит – грубая механическая смесь феррита и цементита, обозначающаяся - a + Fe3C, с межпластинчатым расстоянием 5×10-7 - 7×10-7 м, имеет перламутровый цвет (отсюда и название), концентрация углерода 0,8 % масс. Он является продуктом эвтектического распада аустенита при 727 °С. Структура его также как и ледебурита состоит из следующих друг за другом пластинок его составляющих: а именно, феррита и цементита (темные полосы - цементит, светлые – феррит) (рис. 1.35).

Рис. 1.35 - Структура перлита
1.4.4. Диаграмма состояния железо – цементит (метастабильное равновесие)
Как уже упоминалось чуть выше, железо, взаимодействуя с углеродом, может образовывать ряд химических соединений. Поскольку каждое устойчивое химическое соединение может быть рассмотрено как компонент, то и диаграмму системы железо-углерод можно проанализировать только до образования в ней карбида железа - Fе3С – концентрация углерода 6,67 % (табл. 1.3).
Таблица 1.3 - Точки диаграммы Fе - Fе3С
| Обозначение точек | Температура, °С | Концентрация углерода, % масс | Пояснение |
| A | 0,00 | температура плавления железа | |
| D | 6,67 | температура плавления цементита | |
| H | 0,10 | предельная концентрация углерода в d-феррите | |
| J | 0,16 | максимальное количество углерода в аустените | |
| B | 0,50 | концентрация углерода в жидкой фазе, находящейся в равновесии с d-ферритом и аустенитом | |
| N | 0,00 | полиморфное превращение a « g | |
| E | 2,14 | предельное содержание углерода в аустените | |
| C | 4,31 | максимальное количество углерода в ледебурите (g + Fe3C) | |
| F | 6,67 | наибольшая концентрация углерода в цементите | |
| G | 0,00 | полиморфное превращение a « g | |
| P | 0,02 | предельное содержание углерода в феррите (a) | |
| S | 0,80 | максимальное количество углерода в перлите (a + Fe3C) | |
| K | 6,67 | наибольшая концентрация углерода в цементите | |
| Q | 0,006 | минимальное содержание углерода в феррите | |
| L | 6,67 | предельное количество углерода в цементите |
Это связано с тем, что наибольшее практическое значение имеет только часть диаграммы состояния железо-углерод, в которой показано формирование цементита, так как сплавы, содержащие большое количество углерода, очень хрупкие и практически не применяются в промышленности. Поэтому диаграмму состояния системы железо-углерод изображают только до концентрации углерода 6,67 % масс и называют диаграммой состояний железо-цементит (рис. 1.36). Ось абсцисс на данном рисунке двойная: концентрация углерода и цементита соответственно.
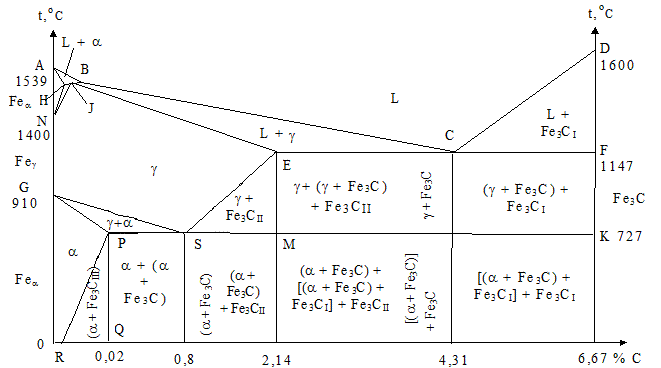
Рис.1.36 - Диаграмма состояния железо - цементит
В целом диаграмму железо – цементит можно рассматривать как комбинированную: с образованием механических смесей (эвтектики и эвтектоида), формированием твердых растворов с ограниченной растворимостью углерода и химического соединения.
Диаграмма довольно сложная, и поэтому ее анализ удобнее проводить, разделив на отдельные части. Линии диаграммы состояния Fе - Fе3С, определяющие первоначальный процесс кристаллизации сплавов с концентрацией углерода до 0,5 %, имеют следующие обозначения, принятые в классическом материаловедении и научной литературе, и физический смысл: АВ (ликвидус) показывает температуру начала кристаллизации d-феррита (d) из жидкого сплава (L); АН (солидус) является температурной границей области расплава и кристаллов d-феррита (d); ниже этого участка существует только d-феррит; НJВ - прямая перитектического нонвариантного (c = k – f + 1 = 2 – 3 + 1 = 0) равновесия (1499 °С); по достижении соответствующей ей температуры, протекает реакция Lв + dн = gJ (жидкость L взаимодействует с кристаллами d-феррита Н с образованием аустенита состава J). Отрезок HN определяет температуру начала выделения кристаллов аустенита g из a (d-феррита). Линия JN – температурный рубеж зоны обоих твердых растворов a и g, ниже ее сплав имеет лишь структуру аустенита (рис. 1.37).
Проведем анализ процесса кристаллизации на данном участке диаграммы. Возьмем сплав с содержанием углерода меньше 0,1 %. В интервале 1 - 2 из жидкой фазы (L) начинают выделяться кристаллы d-феррита, и он становится двухфазным (L + d). При этом концентрация жидкости варьируется по кривой АВ, а количество твердой фазы определяется отрезком АН.
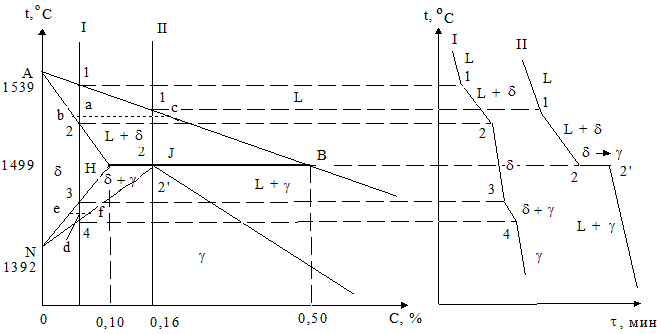
Рис. 1.37 - Фрагмент диаграммы состояния Fe - Fe3C. Первичная кристаллизация малоуглеродистых сплавов
То есть в точке а они будут определяться проекциями пунктов с и b, а количества отвечающих им фаз рассчитываться по отношению отрезков 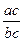 и
и 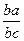 соответственно (правило рычага). В пункте 2 количество жидкого сплава становится равным нулю, процесс кристаллизации заканчивается с образованием однородного твердого раствора d-феррита. До точки 3 наблюдается простое охлаждение данной структуры. Далее в диапазоне 3 - 4 осуществляется превращение d-феррита в аустенит (g). Концентрация состояний меняется согласно положениям линий HN и JN. Так для пункта d они могут обуславливаться проекциями точек f и e, а количество фаз – соотношением участков, а именно, d/g =
соответственно (правило рычага). В пункте 2 количество жидкого сплава становится равным нулю, процесс кристаллизации заканчивается с образованием однородного твердого раствора d-феррита. До точки 3 наблюдается простое охлаждение данной структуры. Далее в диапазоне 3 - 4 осуществляется превращение d-феррита в аустенит (g). Концентрация состояний меняется согласно положениям линий HN и JN. Так для пункта d они могут обуславливаться проекциями точек f и e, а количество фаз – соотношением участков, а именно, d/g = 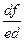 . И наконец в пункте 4 сплав полностью обретает структуру аустенита. При концентрации углерода 0,16 % вначале затвердевание системы осуществляется аналогично предыдущему сплаву с формирования d-феррита переменного состава. В точке J, исходные кристаллы твердого раствора d-феррита в результате взаимодействия с жидкой фазой при перитектической реакции полностью превращаются в аустенит. Для нашей системы с содержанием углерода в интервале 0,1 - 0,5 % отличие будет наблюдаться лишь во второй части процесса кристаллизации. То есть справа или слева от точки J по завершении перитектической реакции состояние сплава будет определяться избытком твердой a (d-феррита) или жидкой (L) фаз, при последующем охлаждении превращающихся в однофазную структуру аустенит в соответствии с кривыми JN и JE (точка E на данном отрезке диаграммы не указана).
. И наконец в пункте 4 сплав полностью обретает структуру аустенита. При концентрации углерода 0,16 % вначале затвердевание системы осуществляется аналогично предыдущему сплаву с формирования d-феррита переменного состава. В точке J, исходные кристаллы твердого раствора d-феррита в результате взаимодействия с жидкой фазой при перитектической реакции полностью превращаются в аустенит. Для нашей системы с содержанием углерода в интервале 0,1 - 0,5 % отличие будет наблюдаться лишь во второй части процесса кристаллизации. То есть справа или слева от точки J по завершении перитектической реакции состояние сплава будет определяться избытком твердой a (d-феррита) или жидкой (L) фаз, при последующем охлаждении превращающихся в однофазную структуру аустенит в соответствии с кривыми JN и JE (точка E на данном отрезке диаграммы не указана).
На основании изложенного можно отметить, для сплавов с концентрацией углерода менее 0,5 % масс первоначальный процесс кристаллизации в любом случае будет заканчиваться формированием аустенита.
Основываясь на сделанном заключении, для исследования системы железо-цементит преимущественно в твердом состоянии, можно использовать упрощенный вариант диаграммы (рис. 1.38). На данном варианте диаграммы отсутствуют кривые перитектического превращения и условно принимается, что жидкий сплав с концентрацией углерода до 0,5 % непосредственно трансформируется в аустенит (g). Кривая АСD - линия ликвидус, которая на участке АС соответствует температурам начала выпадения кристаллов аустенита (g) из жидкого сплава (L), в области СD - представляет геометрическое место точек, отвечающих температурам начала кристаллизации первичного цементита (Fe3СI) из жидкой фазы (L). Линия АЕСF - солидус, криволинейный кусочек АЕ которой определяет окончание затвердевания аустенита. Прямолинейный же участок ECF является геометрическим местом точек, соответствующих также концу кристаллизации аустенита (ЕС)и первичного цементита - Fe3CI (CF), и одновременно отвечает температурам изотермического превращения жидкого сплава состава пункта С в двухфазную эвтектику - ледебурит – Lc ® gЕ + Fe3C. Данная реакция наблюдается только у сплавов с содержанием углерода более 2,14 % масс.
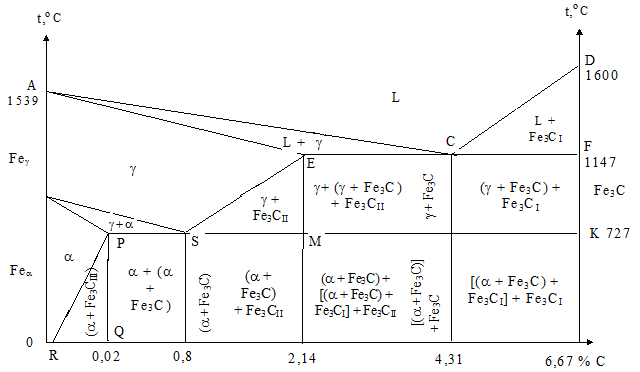
Рис. 1.38 - Упрощенный вариант диаграммы состояния железо - цементит
Кривые ограничения максимальной растворимости углерода в фазовых составляющих железоуглеродистых сплавов DC, ES и PQ расположены на диаграмме в интервалах трех уровней температур: 1 – от 1600 до 1147 °С (DC), 2 – 1147 – 727 °С (ES) и 3 – от 727 до 25 °С (в некоторых источниках до 600 °С – PQ). Эти линии имеют одну общую особенность: по форме они обращены выпуклой стороной к оси температур чистого железа и определяют максимальную растворимость углерода в той фазе, которая расположена на диаграмме левее данной кривой. Это значит, что отвечающие им области DC, ES и PQ характеризуют предельную концентрацию неметалла: 1 в жидком сплаве L от 6,67 % в точке D и 4,31 % - пункт С; 2 в аустените g от 2,14 % точка Е до 0,8 % для точки S; 3 в феррите a - 0,02 - 0,006 % в пунктах Р и Q. При понижении температуры системы меньше точек растворимости углерода из фазы, находящейся слева от соответствующей им кривой, выделяется избыток неметалла, образуя цементит определенного уровня: 1 - треугольник DCF – первичный (Fe3CI);2 - ESM – вторичный (Fe3CII) и 3 - PQR – третичный (Fe3CIII). Отрезки ЕС и SP ограничивают соответственно изотермическое превращение жидкого сплава в ледебурит и аустенита в перлит (рис. 1.38).
Диаграмму состояния Fе - Fе3С по оси абсцисс – концентрация углерода – делят на следующие участки: 0 - 0,02 % (точка Р); 0,02 - 0,80 % (область PS); 0,80 % (точка S); 0,80 - 2,14 % (интервал SM); 2,14 % (пункт Е); 2,14 - 4,31 % (диапазон EC); 4,31 % (точка С) и 4,31 - 6,67 % (отрезок CF). Сплавы соответственно такому делению называют: 1 - технически чистое железо; 2 - доэвтектоидные; 3 - эвтектоидная; 4 - заэвтектоидные стали; 5 - доэвтектические; 6 - эвтектический и 7 - заэвтектические чугуны. Данное разделение принято называть классификацией железоуглеродистых сплавов по диаграмме состояния.
На каждом из вышеуказанных участков рассмотрим кристаллизацию типовых сплавов, обозначенных римскими цифрами I - VII (рис. 1.39 и 1.40).
Сплав I - технически чистое железо (с содержанием углерода от 0 до 0,02 %). При температурах выше точки 1 система однофазна и находится в жидком состоянии (L). В диапазоне 1 - 2 осуществляется кристаллизация сплавов в виде g-твердого раствора – аустенита и система становится двухфазной - L + g. В пункте 2 количество жидкого состояния становится равным нулю, затвердевание сплавов заканчивается и существует лишь однородный твердый раствор аустенита - g. На участке 2 - 3 структурных превращений системы не наблюдается, а фиксируется лишь простое ее охлаждение.
В точке пересечения прямой сплава с линией GS диаграммы - 3 - начинается перекристаллизация аустенита в феррит (g → a превращение), которая заканчивается в точке 4 полным образованием a-твердого раствора и отрезок 4 - 5 характеризует обычное его остывание.
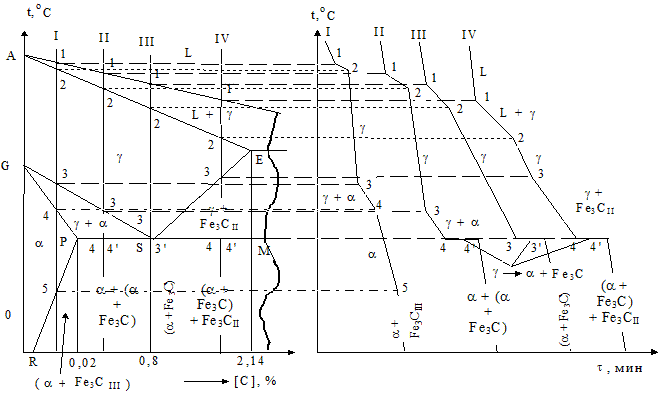
Рис. 1.39 - Часть диаграммы состояния железоуглеродистых сплавов (до 2,14 % С) и их кривые равновесного охлаждения
И наконец на последнем участке 5 - 6 из a-феррита происходит выделение избыточного количества углерода в виде третичного цементита - Fe3CIII. Таким образом, конечная структура сплавов с концентрацией углерода от 0 до 0,02 % представляет зерна феррита с включениями третичного цементита в наиболее напряженных точках границ зерен (рис. 1.40, а).

Рис. 1.40. Структура сталей с различной концентрацией углерода: а – 0,05; б – 0,25; в – 0,40; г – 0,70; д – 0,80; е – 1,20 %
Сплав II – доэвтектоидные стали (0,02 - 0,80 % С). Здесь, как и в предыдущем сплаве кристаллизация до точки 4 имеет те же закономерности и также приводит к перекристаллизации аустенита в феррит. И на этом сходство заканчивается. Далее в пункте 4 температура системы достигает 727 °С, что соответствует ее значению при изотермическом превращении аустенита в перлит – двухфазную структуру, представляющую, как уже отмечалось, механическую смесь феррита и первичного цементита. Данная трансформация аустенита называется его перлитным распадом. Он возможен при выполнении двух условий в системе: когда температура будет равна 727 °С и концентрация углерода в аустените будет достигать 0,8 %.
При наличии трех фаз (при этой температуре): феррит (0,02 % С), цементит (6,67 % С) и аустенит (0,8 % С) - система нонвариантна (с = 2 + 1 - 3 = 0). В точке 4’ не перешедший в феррит аустенит превращается в перлит и дальнейшее охлаждение сплава до комнатной температуры протекает без каких-либо изменений его структуры.
В итоге после окончательного (равновесного) охлаждения наш сплав и все доэвтектоидные стали имеют структуру феррит + перлит (рис. 1.40, б - г). Чем выше содержание углерода в сплаве, тем больше в структуре стали образуется перлита и меньше избыточного феррита. При концентрации углерода до 0,6 - 0,7 % феррит выделяется в виде оторочки вокруг зерен перлита (ферритная сетка).
Если знать общее содержание неметалла в сплаве, то можно рассчитать предполагаемый состав его структуры: а именно количество перлитной составляющей. Для этого необходимо составить следующую пропорцию: если концентрация углерода составляет 0,8 %, то структура будет на 100 % состоять из перлита, а для сплава с содержанием 0,4 % С масс (сталь 40) количество перлита будет равно Х %. Отсюда концентрацию перлита в стали 40 вычислим по уравнению: 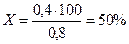 .
.
Сплав III – эвтектоидная сталь (концентрация углерода 0,8 %). Затвердевание системы до температуры 727 °С в пункте 3, соответствующей точке S на диаграмме, протекает аналогично двум первым сплавам с формированием аустенита (отрезок 1 - 2) и простым его охлаждением (участок 2 - 3). Достигнув точки 3 сплав охлаждается до 727 °С и начинает претерпевать изотермическое разложение g-твердого раствора g 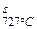 ® (a + Fe3C), которое продолжается некоторое время и конец его определяется пунктом 3’, когда последние зерна аустенита превратятся в перлит. Ниже точки 3' идет простое остывание данной итоговой структуры сплава – перлита (рис. 1.40, д).
® (a + Fe3C), которое продолжается некоторое время и конец его определяется пунктом 3’, когда последние зерна аустенита превратятся в перлит. Ниже точки 3' идет простое остывание данной итоговой структуры сплава – перлита (рис. 1.40, д).
Сплав IV – заэвтектоидные стали (от 0,80 до 2,14 % С). Подобно всем предыдущим сплавам до точки 3 в системе осуществляются те же процессы, которые приводят к формированию аустенита и его охлаждению. Однако в самом месте пересечения кривой ES с линией сплава g-твердый раствор пересыщается углеродом, т. е. его концентрация в аустените при температурах ниже пункта 3 становится больше, чем предельная растворимость данного неметалла в этой структурной составляющей в тех же условиях. Поэтому избыток углерода по границам перлитных зерен образует сетку вторичного цементита Fe3CII. Это происходит на участке 3 - 4, который также характеризуется уменьшением концентрации углерода по линии ES до 0,8 % в точке 4. Здесь же температура сплава достигает 727 °С. То есть в данный момент выполняются оба условия протекания перлитного распада аустенита, осуществляющегося на отрезке 4 - 4’. Толщина цементитной оболочки растет пропорционально содержанию углерода в стали. При этом увеличивается и хрупкость сплава. При температурах ниже точки 4’ регистрируется простое охлаждение сформировавшейся итоговой структуры вторичного цементита и перлита (рис. 1.40, е). Стали с концентрацией 1,3 - 1,5 % С практически не применяются из-за высокой хрупкости.
Чугуны, имеющие равновесную структуру согласно диаграмме железо-цементит и содержащие углерод в связанном состоянии в виде карбида железа, носят название «белых», так как их излом имеет белый цвет по сравнению с таковым у промышленных серых, в которых весь присутствующий неметалл находится в аллотропной модификации графита.
Сплав V – доэвтектические чугуны (2,14 - 4,31 % углерода). До точки 2 аналогично рассматриваемым выше системам протекает образование g-твердого раствора из жидкой фазы и структура сплава складывается из двух составляющих Lс + gE (рис. 1.41).
Общим для всех данных пяти сплавов является то, что состав жидкой фазы определяется кривой АС, а твердой – линией АЕ. Дальнейший отвод тепла нарушает устойчивое состояние жидкости и в точке 2 – 1147 °С - она начинает превращаться в эвтектику, называемую ледебуритом, по реакции L  ® (g + Fe3C). Данный процесс заканчивается в пункте 2’. При более низких температурах в интервале 2’ - 3 по границам первичных зерен аустенита образуются и растут зародыши вторичного цементита. То есть на этом участке сплав будет состоять из g + (g + Fe3C) + Fe3CII. В точках 3 начинается и 3’ заканчивается перлитный распад аустенита всех существующих в этот момент структур. В пункте 3’ формируется конечное строение сплава V, складывающееся из зерен перлита (a + Fe3C), вокруг которого располагается оболочка вторичного цементита, а расстояния между перлитными составляющими заполняют включения низкотемпературного ледебурита – [(a + Fe3C) + Fe3C]. Ниже точки 3’ происходит простое остывание данной структуры (рис. 1.41 и 1.42, а).
® (g + Fe3C). Данный процесс заканчивается в пункте 2’. При более низких температурах в интервале 2’ - 3 по границам первичных зерен аустенита образуются и растут зародыши вторичного цементита. То есть на этом участке сплав будет состоять из g + (g + Fe3C) + Fe3CII. В точках 3 начинается и 3’ заканчивается перлитный распад аустенита всех существующих в этот момент структур. В пункте 3’ формируется конечное строение сплава V, складывающееся из зерен перлита (a + Fe3C), вокруг которого располагается оболочка вторичного цементита, а расстояния между перлитными составляющими заполняют включения низкотемпературного ледебурита – [(a + Fe3C) + Fe3C]. Ниже точки 3’ происходит простое остывание данной структуры (рис. 1.41 и 1.42, а).
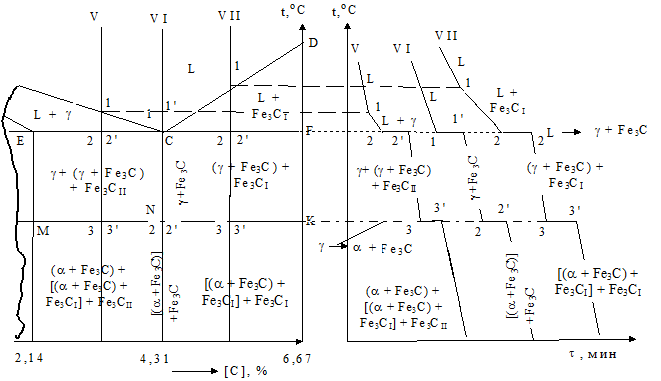
Рис. 1.41. Фрагмент диаграммы состояния железо-цементит (2,14 - 6,67 % С) с соответствующими кривыми охлаждения
Сплав VI – эвтектический чугун. В интервале 1 - 1’ (линия ЕСF) существует нонвариантное (с = 0) равновесие аустенита gЕ, цементита (Fе3С) и жидкой фазы Lс. В результате кристаллизации жидкости по реакции Lс ® gЕ + Fe3C образуется эвтектика, также называемая ледебурит и состоящая в момент образования из аустенита и цементита. До точки 2 происходит лишь ее простое охлаждение, которое с достижением 727 °С нарушается и характеризуется разложением аустенита в перлит g  ® (a + Fe3C), которое продолжается некоторое время и конец его определяется пунктом 2’, когда последние зерна аустенита превратятся в перлит. Ниже точки 2' идет простое остывание итоговой структуры сплава, состоящей из низкотемпературного ледебурита – [(a + Fe3C) + Fe3C] (рис. 1.42, б).
® (a + Fe3C), которое продолжается некоторое время и конец его определяется пунктом 2’, когда последние зерна аустенита превратятся в перлит. Ниже точки 2' идет простое остывание итоговой структуры сплава, состоящей из низкотемпературного ледебурита – [(a + Fe3C) + Fe3C] (рис. 1.42, б).


Рис. 1.42. Микроструктура белых чугунов: а – доэвтектический (ледебурит + перлит); б – эвтектический (ледебурит); в – заэвтектический (ледебурит + первичный цементит)
Сплав VII - заэвтектические чугуны (4,30 - 6,67 % С) Он начинает затвердевать с понижением температуры по линии ликвидус СD, когда в жидкой фазе зарождаются и растут кристаллы цементита 0 отрезок 1 - 2. Концентрация углерода в жидком сплаве с понижением температуры уменьшается по линии ликвидус. При 1147 °С – точка 2 - жидкость достигает эвтектической концентрации 4,3 % С (пункт С) и кристаллизуется на участке 2 - 2’ с образованием ледебурита gЕ + Fe3C. До точки 3 никаких превращений не наблюдается, а регистрируется охлаждение трехфазной структуры (gЕ + Fe3C) + Fe3C. В точке 3 при пересечении линии сплава с эвтектоидной прямой PSK, как и для всех предыдущих, наступает перлитное разложение аустенита, которое заканчивается в пункте 3’, и конечная структура ниже этой точки сплава будет следующей - [(a + Fe3C) + Fe3C] + Fe3C (рис. 1.42, в).
Для полного понимания процесса кристаллизации в системе железо-углерод отдельно рассматривается кристаллизация чистого железа (рис. 1.43).
Таким образом, индивидуальные железоуглеродистые сплавы после окончания процесса кристаллизации каждый имеет свою структуру, указанную выше. Однако, как можно заметить, ниже 727 °С для всех фазовый состав обусловливается лишь различным соотношением в нем феррита и цементита, относительное содержание которых можно определить в зависимости от концентрации углерода в сплаве по диаграмме состояния.
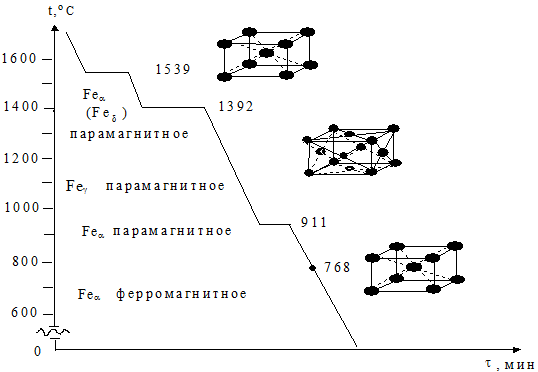
Рис. 1.43. Кривая охлаждения чистого железа со структурами его полиморфных модификаций
Вопросы для самопроверки
1. В виде каких аллотропных (полиморфных) модификаций в зависимости от температуры может существовать железо? Дайте их общую характеристику.
2. Приведите физико-механические показатели железа?
3. Охарактеризуйте химические свойства железа?
4. Чем можно объяснить большую растворимость углерода в g-железе по сравнению с его a-модификацией?
5. Какие твердые растворы образуются при растворении углерода в железе? Какова их структура? Как она влияет на свойства раствора?
6. Какое химическое соединение, образующееся в системе железо - углерод, приводится на одноименной диаграмме состояния? Какова его кристаллическая решетка? Почему его называют цементитом?
7. Какие двухфазные структуры образуются в системе железо – цементит? Назовите и охарактеризуйте их?
8. Почему диаграмму состояния железо – углерод отображают только до [C] = 6,67 % масс?
9. Приведите значения температуры и концентраций углерода в характерных точках диаграммы состояния. Каким структурам и превращениям они соответствуют?
10. По основной диаграмме состояния проанализируйте процессы кристаллизации сплавов с концентрацией углерода: а) от 0 до 0,5 %; б) от 0,5 до 0,8 %; в) равную 0,8 %; г) в интервале 0,8 – 2,14 %; д) от 2,14 до 4,31 %; е) равную 4,31 % и ж) в интервале 4,31 – 6,67 %.
11. Какие конечные структуры имеют стали и чугуны, образующиеся в предыдущих диапазонах концентраций углерода на диаграмме состояния?
12. Как структурный и фазовый состав стали и чугуна зависят от содержания углерода и температуры?
Дата добавления: 2015-09-21; просмотров: 6572;
