Диаграммы состояния сплавов. Их типы и построение
Процесс кристаллизации металлических сплавов и связанные с ним закономерности их строения описываются диаграммами состояния или фазового равновесия.
Диаграмма состояния – графическое изображение фазового состава и структуры любого сплава в зависимости от его концентрации и температуры. Она показывает устойчивые состояния, которые при определенных условиях обладают минимумом свободной энергии, и какие равновесные фазы существуют в системе в данный момент. Поэтому ее еще можно назвать диаграммой равновесия.
В любой системе количество фаз, находящихся в равновесии, зависит от внутренних и внешних условий. Закономерности всех изменений, осуществляющихся в системе, подчинены закону равновесия, называемому правилом фаз или законом Гиббса. Оно выражает зависимость между числами степеней свободы с, компонентов k и фаз системы f, находящихся в равновесии. Под степенью свободы (вариантностью) системы понимают количество внешних и внутренних факторов (температура, давление и концентрация), которое можно изменять без перемены числа фаз в системе. В общем виде данное правило отображают формулой: с = k - f + 2.
Обычно все превращения в металлах и сплавах выполняют при постоянном атмосферном давлении. Тогда правило фаз записывают следующим образом: с = k - f + 1. Оно позволяет корректировать правильность построения диаграмм состояния.
Для однокомпонентной системы при кристаллизации чистого металла k = 1. Металл существует в виде жидкости выше своей температуры плавления, т. е. в данный момент он однофазен (f = 1), и число степеней свободы также будет (с = k - f + 1 = 1 – 1 + 1 = 1) равно 1 – система моновариантна. Это говорит о том, что на данном этапе изменения температуры не повлияют на агрегатное состояние элемента. В процессе кристаллизации в металле будут находиться две фазы (f = 2) – жидкая и твердая, что вызовет уменьшение вариантности (с = k - f + 1 = 1 – 2 + 1 = 0) до нуля – система нонварианта. Это означает, что обе фазы существуют в равновесии при строго определенной температуре и ее изменение повлечет за собой коренные превращения в системе.
Построение диаграмм фазового равновесия осуществляют разнообразными экспериментальными приемами. Наиболее часто пользуются способом термического анализа. Сущность данного метода заключается в следующем. Отбирают несколько сплавов с различным соотношением масс входящих в них компонентов. Сплавы нагревают до их расплавления, далее охлаждают и фиксируют скорость процесса, измеряя температуру и время. По результатам замеров строят термические кривые в координатах температура – время. В ходе анализа получают серию графиков охлаждения или нагревания, на которых при температурах фазовых превращений наблюдаются точки перегибов и температурные остановки. Температуры, соответствующие данным переходам, называются критическими точками.
Для более полного построения диаграмм плавкости в дополнение к термическому анализу при изучении строения и структуры фаз сплавов применяют микроскопический и рентгеноструктурный методы. Используя полученные кривые охлаждения (нагревания), методом параллельного переноса строят диаграмму состояния сплава в координатах температура – концентрация. Для двухкомпонентной системы по оси ординат (две) откладывают температуру, на оси абсцисс – концентрацию.
Общая концентрация обоих компонентов в сплаве равна 100 %, и любая точка на оси абсцисс отвечает определенному содержанию каждого компонента. По мере удаления, например, от точки А увеличивается концентрация второго элемента и в конце (пункт В) она достигнет 100 %. Поэтому обе крайние ординаты на диаграмме описывают температуру чистых металлов (рис. 1.21).
|
|
|
|
|
|
Рис. 1.21 - Координаты для изображения состояния двухкомпонентной системы
Каждая точка на диаграмме показывает состояние сплава заданной концентрации при определенной температуре. Любая вертикаль отвечает изменению температуры сплава конкретного состава.
Превращение фазового состояния отмечается точкой. Линии, их соединяющие, разграничивают на диаграмме области фазовых трансформаций. Точки, отвечающие началу процесса кристаллизации, называют точками ликвидуса, линия их соединяющая - линией ликвидуса («ликва» - жидкость). Выше этой черты все сплавы находятся в жидком состоянии.
Точки, соответствующие окончанию процесса затвердевания, именуют точками солидуса, а черта, им отвечающая линией солидуса («солид» - твердое тело). Ниже ее все сплавы являются твердыми телами. На диаграмме состояния указывают фазовый состав и структуру сплавов в различных ее областях. Вид диаграммы состояния зависит от характера взаимодействия основных компонентов сплавов в жидкой и твердой фазах и типа образующихся при этом структур.
Диаграммы состояния для сплавов с неограниченной растворимостью компонентов в жидком и твердом состояниях без образования химических соединений. Компоненты: А, В – первый и второй металлы. Фазы: жидкость - L и твердый раствор - a.
Если оба элемента сплава неограниченно растворяются друг в друге как в жидком, так и в твердом виде, то возможно существование только двух фаз – жидкого L и твердого растворов a (с = 2 – 2 + 1 = 1). Следовательно, трех фаз быть не может, кристаллизация при постоянной температуре не наблюдается и горизонтальная линия на диаграмме отсутствует.
Затвердевание чистых металлов, например системы Cu – Ni, описывают кривыми охлаждения (рис. 1.22, график 1).
|
|
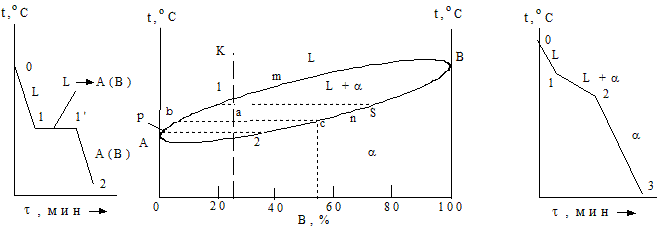
Рис. 1.22 - Кривые охлаждения и диаграмма состояния в системе медь-никель
Выше точек плавления (1084,5 °С и 1455 °С соответственно) оба металла находятся в жидком состоянии. Понижение температур до соответствующих значений вызывает фазовое превращение - затвердевание, а еще большее уменьшение – простое охлаждение твердого металла. Следовательно, на графике отрезки 0 - 1 соответствуют остыванию жидкости, 1 - 1’ – кристаллизации металлов и 1 - 2 – их охлаждению в виде твердых тел. Кривые охлаждения всех сплавов данной системы представляют собой зигзагообразную линию (рис. 1.21, график 2). При температурах, соответствующих точкам 0 для сплавов I и II, система находится в состоянии однородного жидкого раствора, в котором атомы первого металла (меди) равномерно перемешаны со структурными единицами второго элемента (никеля).
По достижении температуры значения пункта 1 жидкий раствор становится насыщенным по отношению к a-фазе, начинается кристаллизация сплавов, что сопровождается уменьшением скорости охлаждения. В диапазоне температур 1 - 2 система представляет смесь насыщенных жидкого и твердого растворов. В точке 2 кристаллизация сплавов заканчивается и ниже этой температуры до пункта 3 уже охлаждается лишь ненасыщенный твердый раствор a без каких-либо его превращений (рис.1.23).
|
|
|
|

|

|


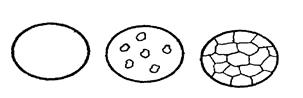
|
Рис. 1.23 – Схема формирования микроструктуры сплавов с неограниченной растворимостью компонентов, например медь-никель
Наблюдаемые критические точки для нескольких сплавов переносят на график зависимости концентрации сплава от температуры, все пункты начала кристаллизации и конца затвердевания соединяют между собой двумя линиями и получают диаграмму состояния. Такие диаграммы характерны для металлов, которые имеют одинаковую кристаллическую решетку с мало различающимися параметрами, например, пары медь-никель, a-железо-хром и некоторые другие.
Точки, отвечающие началу кристаллизации, называют точками ликвидуса, линия их соединяющая линией ликвидуса («ликва» - жидкость). Выше этой черты все сплавы находятся в жидком состоянии. Пункты, соответствующие концу затвердевания, именуют точками солидуса, а черта им отвечающая линией солидуса («солид» - твердое тело). Ниже ее все сплавы являются твердыми телами.
На диаграмме состояния указывают фазовый состав и структуру сплавов в различных ее областях.
Проведем анализ диаграммы для сплава, содержащего 25 % Ni и 75 % Cu. Для этого используем правило отрезков или рычага. Оно применимо только для двухфазных систем и заключается в том, что через точку а, характеризующую состояние данного сплава, проводят горизонтальную прямую (коноду) до пересечения ее с линиями ликвидуса и солидуса. Точки пересечения этой прямой с кривыми диаграммы (б и с) отображают на ось концентраций. Проекции этих точек покажут состав жидкой и твердой фаз сплава. Так в (•)с это будет твердый раствор a, количественный состав которого соответствует около 45 % Ni и 55 % Cu (рис. 1.21).
При дальнейшем охлаждении состав кристаллов и жидкого раствора изменяется по пути 2 - s, p - 1 соответственно. Таким образом, в процессе затвердевания количество никеля в сплаве уменьшается. Это можно записать таким образом: p - 1, t1 - t2 и 2 - s. Ниже температуры t2 осуществляется лишь охлаждение твердого раствора a.
Второе положение правила отрезков позволяет определять количественное соотношение фаз системы при любой температуре. Для этого вновь обратимся к прямой, проведенной через точку а на рис. 1.22. Составы жидкой и твердой фаз будут определяться проекциями ее пунктов пересечения (б и с) на линиях ликвидуса и солидуса соответственно. Количество фаз обратно пропорционально отрезкам проведенной прямой: часть жидкого состояния Qж/Qс = ас/bc;а доля твердой фазы Qт/Qс = ba/bc,где Qж – количество жидкого расплава; Qт – содержание кристаллов твердого тела; Qс – масса сплава.
Рассмотрим диаграммы состояния сплавов, в которых оба его элемента неограниченно растворимы друг в друге в жидкой фазе, ограниченно в твердом состоянии и совместно химически не взаимодействуют.
Компоненты: А – первый и В – второй металлы. Фазы: L - жидкость, a- и b - твердые растворы. В сплавах такого рода наблюдается наличие: жидкой фазы и твердых растворов B в А (a-раствор) и А в B (b-раствор). Возможно нонвариантное равновесие при одновременном присутствии трех фаз (с = 2 – 3 + 1 = 0). В зависимости от типа реакций, протекающих в условиях существования состояний, могут наблюдаться два вида диаграмм: с эвтектикой и перитектикой (рис. 1.24 и 1.25).
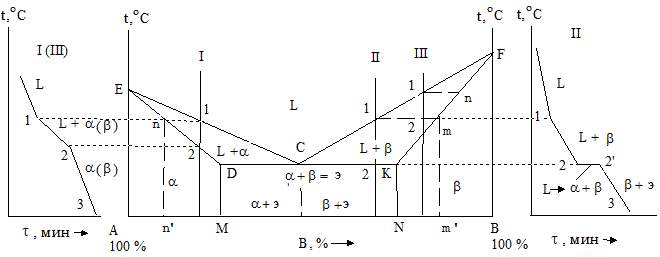
Рис. 1.24 - Диаграммы состояния и кривые охлаждения для сплавов, в которых при образовании твердых растворов происходит эвтектическая реакция
В данной системе не образуются фазы, представляющие собой чистые элементы. Из жидкости выделяются только твердые растворы. На диаграмме около вертикалей А и B, соответствующих свободным компонентам, располагаются области существования твердых растворов a и b (рис. 1.24). Предельные растворимости B в A и наоборот определяются линиями DM и KN. Окончание кристаллизации образующейся структуры сплава происходит по эвтектической реакции Lс ® ad + bk. Кривые ECF – линия ликвидуса, а EDCKF – солидуса соответственно.
Пользуясь правилами фаз и отрезков можно проследить за процессом кристаллизации любого сплава в данной системе. Затвердевание сплавов I и III аналогично кристаллизации системы Cu - Ni. Выше точки 1 сплавы имеют жидкое состояние. В самом пункте 1 начинается и в месте 2 заканчивается их затвердевание. При этом образуются кристаллы твердого раствора a (или b), а состав остающейся жидкой фазы изменяется по линии 1 - С. Содержание компонентов твердой фазы трансформируется по кривой n - 2. При дальнейшем понижении температуры никаких фазовых превращений в сплавах не осуществляется.
Кристаллизация сплавов II протекает немного по-другому. Как и в двух предыдущих случаях до точек 1 сплавы находятся в расплавленном (жидком) виде. В интервале температур 1 - 2 происходит процесс кристаллизации. При этом в системе формируются кристаллы твердых растворов a или b. С уменьшением температуры составы твердой и жидкой фаз изменяются по линиям mD или mK и 1 - С. По достижении точки 2 (горизонталь DCK) наступает эвтектическая реакция – из жидкости состава, описывающегося точкой С, выделяются кристаллы твердых растворов a и b, составы которых характеризуются точками D и K.
Перейдем ко второй разновидности диаграмм состояния сплавов с ограниченной растворимостью компонентов (рис. 1.25). Элементы и фазы здесь такие же. Для данного типа систем в процессе кристаллизации возможно взаимодействие жидкости с ранее выпавшими кристаллами с формированием нового вида L + b ® a. Реакция подобного типа называется перитектической. Кривые СРЕ и CFKE – линии ликвидуса и солидуса соответственно. Затвердевание сплавов I и IV происходит аналогично системе Cu - Ni. Иначе осуществляется кристаллизация составов, расположенных между точками F и P, т. е. II и III. При застывании сплава, с концентрацией компонентов, соответствующей точке К, из жидкости выпадают и растут кристаллы твердого раствора a. В самом пункте К происходит перитектическое превращение, описываемое уравнением Lр + aF ®bк. При этом c = 2 – 3 + 1 = 0, т. е. реакция характеризуется постоянной температурой. В сплавах, размещенных левее точки К, например II, в пункте 2 также осуществляется перитектическая реакция Lp + aF ® aизб + bк, приводящая к образованию твердого раствора b. В данном случае в диапазоне 2 - 3 выделяются кристаллы твердых растворов a и b, составы которых характеризуются точками F и K. Для сплавов, расположенных правее места К, например III, количество выделившейся a-фазы невелико и она вся будет израсходована на перитектическое превращение Lр + aF ® Lизб + bк. При дальнейшем понижении температуры на отрезке 2 - 3 в системе будут образовываться и расти зерна твердого раствора b. Затвердевший сплав будет иметь соответствующую структуру.

Рис. 1.25 - Диаграммы состояния и кривые охлаждения для сплавов, в которых при образовании твердых растворов происходит перитектическое превращение
Разберем диаграмму состояния сплавов, в которых оба компонента в жидком состоянии неограниченно растворимы друг в друге, в твердом - растворимость их практически отсутствует и не наблюдается формирование химических соединений (на примере системы олово – сурьма). Сплавы таких компонентов при переходе в твердое тело образуют механическую смесь зерен двух чистых металлов (рис. 1.26).

Рис. 1.26 - Кривые охлаждения и диаграмма состояния сплавов свинец-сурьма
Кристаллизация чистого свинца (I) начинается в точке 1 и заканчивается в пункте 1’. Процесс протекает при постоянной температуре 327 °С. Выше этого значения свинец находится в жидком состоянии, ниже (отрезок 1’ - 2) он является твердым телом; при этом осуществляется лишь его охлаждение. На участке 1 - 1’ в соответствии с правилом фаз k = 1 (чистый свинец), f = 2 (жидкость и кристаллы твердого металла). Следовательно, с = k – f + 1 = 1 – 2 + 1 = 0, т. е. изменение температуры не должно происходить. Аналогично кристаллизуется и сурьма при 630 °С (V).
Кривая охлаждения сплава III (13 % Sb и 87 % Pb) подобна таковым обоих чистых металлов. На графике имеется только одна температурная остановка 1 - 1’, т. е. кристаллизация системы осуществляется при постоянной температуре 246 °С. Особенность затвердевания сплава заключается в том, что наблюдается одновременная кристаллизация обоих компонентов. При этом синхронно появляются и растут кристаллы обоих металлов, например, свинца и сурьмы. В итоге формируется мелкокристаллическая механическая смесь двух металлов, называемая эвтектикой. В точке 1’ кристаллизация заканчивается и далее (отрезок 1’ - 2) происходит только охлаждение затвердевшего сплава. Для этого случая по правилу фаз имеем k = 2 (сурьма и свинец), f = 3 (твердые металлы свинец и сурьма и жидкий сплав), с = k – f + 1 = 2 – 3 + 1 = 0. Так как с = 0, то кристаллизация сплава должна протекать при постоянной температуре.
Затвердевание сплава II (5 % Sb и 95 % Pb) осуществляется иначе, чем I, III и V. На его кривой охлаждения регистрируются две критические точки: перегиба 1 (296 °С) и температурная остановка 2 - 2’ (246 °С). Выше пункта 1 сплав имеет жидкое состояние, в самой точке 1 начинается его кристаллизация – появляются первые зародыши зерен свинца. Выделение и рост кристалликов избыточного первого металла продолжаются до пункта 2. При этой температуре часть сплава, оставшаяся в жидком состоянии, будет иметь эвтектический (механическая смесь двух или более разнородных кристаллов, одновременно затвердевающих из жидкости) состав (13 % Sb и 87 % Pb) и кристаллизация будет протекать при постоянной температуре, называемой температурой кристаллизации эвтектики (отрезок 2 - 2’). В точке 2’ затвердевание заканчивается, участок 2’ - 3 соответствует охлаждению закристаллизовавшегося сплава.
При кристаллизации сплава IV (40 % Sb и 60 % Pb) на кривой охлаждения также наблюдаются две критические точки: пункт перегиба 1 (395 °С), соответствующий началу его кристаллизации, и температурная остановка 2 - 2’ (246 °С). Вышеизложенное о затвердевании сплава II относится и к данной системе, отличие заключается лишь в том, что в точке 1 происходит образование кристаллов сурьмы.
Характерная особенность кристаллизации двух последних сплавов состоит в следующем: затвердевание осуществляется в интервале температур (участки 1 - 2). Это подтверждается и правилом фаз. На данных отрезках в системах имеются по две фазы: жидкость и кристаллы соответствующих металлов. Отсюда с = 2 – 2 + 1 = 1, т. е. температура будет переменной.
Сплавы с концентрацией сурьмы меньше 13 % называются доэвтектическими. Состав их отмечается на диаграмме левее точки С. Структура такой системы содержит кристаллики свинца и эвтектики, состоящей из мелких зерен свинца и сурьмы. Система, отвечающая формуле эвтектики (13 % сурьмы), именуется эвтектической. Сплавы с содержанием сурьмы больше 13 % называются заэвтектическими. Их строение – это избыточные кристаллики сурьмы плюс эвтектика. На диаграмме состояния отрезок СF определяет их состав.
Диаграммы четвертого типа описывают затвердевание систем с образованием химического соединения между компонентами (рис. 1.27). Таким образом, пользуясь диаграммой состояния системы, можно легко определить температуру начала и конца плавления (затвердевания) любого сплава, а также структурные составляющие, которые он имеет в твердом состоянии.
Химический состав и структура компонентов определяют свойства сплава. Строение в свою очередь зависит от характера взаимодействия элементов. Следовательно, между диаграммами состояния сплавов и полученными их свойствами существует определенная зависимость. Она впервые и наиболее полно изучена Н. С. Курнаковым, который и представил ее в виде диаграмм состав-свойство (рис. 1.28). Из свойств, приведенных в диаграммах, рассмотрены твердость (кривые 1) и электропроводность (графики 2). Если компоненты сплава образуют механические смеси, то его свойства изменяются по закону прямой линии (рис. 1.28, а). В таком случае невозможно создать сплав, механические и электрические свойства которого оказались бы выше таковых чистых компонентов. При образовании элементами непрерывных твердых растворов свойства сплавов изменяются в соответствии с диаграммами, представленными на рис. 1.28, б. Небольшое введение второго компонента в чистый металл значительно повышает твердость сплава (кривая 1) и снижает электропроводность (линия 2). Поэтому для изготовления проводников используют наиболее чистые металлы, а для создания сплавов высокого электросопротивления – металлы с полной взаимной растворимостью. Кроме того, их вводят в сплав примерно в равных количествах. При формировании элементами ограниченных твердых растворов диаграмма состав - свойства получается составленной из двух ранее рассмотренных (рис. 1.28, в). Если компоненты сплава образуют химические соединения, то свойства его изменяются скачкообразно (рис. 1.28, г). Диаграммы состав – свойство имеют большое практическое значение при создании новых сплавов с заданными характеристиками.
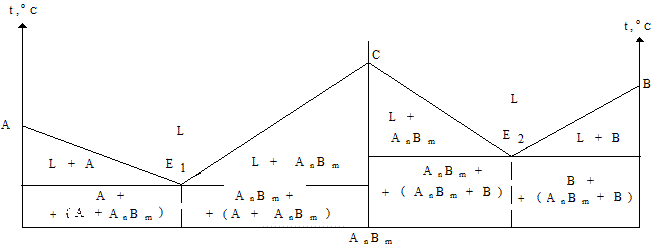
Рис. 1.27 - Диаграмма состояния системы с образованием химического соединения AnBm
|

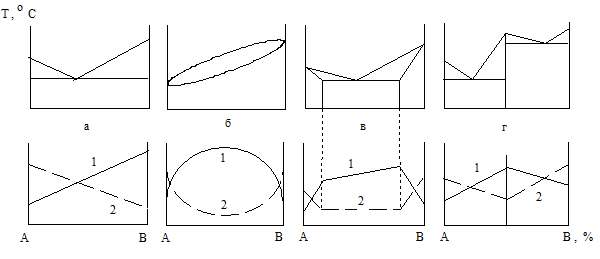
Рис. 1.28. Диаграмма состав – свойство сплавов при различных типах взаимодействия компонентов
Вопросы для самопроверки
1. Что такое механическая смесь? Когда при затвердевании сплавов в их структуре образуются механические смеси?
2. Что такое твердый раствор? Какие виды твердых растворов Вы знаете?
3. Чем отличается твердый раствор замещения от твердых растворов внедрения и вычитания?
4. Какие условия необходимы для неограниченной растворимости металлов?
5. Что такое эвтектика и когда она образуется? Опишите ее процесс кристаллизации.
6. Дайте определение и математическое выражение правила фаз Гиббса. Какие параметры системы оно связывает между собой? Для чего оно применяется?
7. Определите число фаз, их структуру и количество при разных температурах и составах сплавов между линиями ликвидус и солидус в двухкомпонентной системе с полной взаимной растворимостью в жидком и твердом состояниях. Что такое конода?
8. Нарисуйте схему структуры твердого раствора?
9. Как получить пересыщенный твердый раствор в системе сплавов с ограниченной растворимостью? Как называется такой технологический процесс?
10. Что такое диаграмма состояния или плавкости сплава? Что она характеризует?
11. Опишите сущность термического метода построения диаграмм плавкости сплавов. Какие виды диаграмм Вы знаете.
12. Что такое линии ликвидус и солидус? Как с их помощью можно определить структуру образующегося сплава?
13. Что такое правило отрезков или рычага? Как оно позволяет определить состав сплава и соотношение фаз в нем по диаграмме состояния?
14. В чем заключается правило Н. А. Курнакова? Что такое диаграмма состав - свойство? Каково ее практическое значение?
Дата добавления: 2015-09-21; просмотров: 5717;
