Патогенез язвенной болезни.
Согласно современным представлениям язвенная болезнь развивается из-за несоответствия между повреждающим действием желудочного сока и сопротивляемостью слизистой желудка и 12-перстной кишки этому повреждающему действию. Поэтому в основе ЯБ лежит, с одной стороны, усиление кислотно-пептической агрессии и, с другой, - ослабление резистентности слизистой за счет дефицита факторов, защищающих ее от переваривания желудочным соком. Поэтому известное положение «без кислоты нет язвы» - следует трактовать несколько шире – «без агрессии нет язвы», имея в виду то, что повреждающее действие желудочного сока возрастает не только при повышении его кислотности и переваривающей силы, но и при снижении активности защитных факторов.
Кардинальным вопросом патогенеза ЯБ является выяснение путей смещения равновесия между факторами, определяющими повреждающую способность желудка, и защитными свойствами слизистой в сторону явного функционального преобладания первых, чем и создаются условия для язвообразования.
Ответ на этот вопрос многие исследователи пытались дать в ряде обобщающих теорий ульцерогенеза, которые в настоящее время представляют лишь историко-познавательное значение. Так, в механической теории Ашоффа основное внимание уделялось вероятной травматизации слизистой желудка пищевыми продуктами.
Согласно воспалительной теории ведущая роль в генезе язвенной болезни отводится воспалению слизистой с последующим некрозом ткани и образованием на этом месте язвы. Однако остается неясным, как возникают язвы у людей, в анамнезе которых нет гастрита, а также почему язвенная болезнь возникает только у малой части страдающих гастритами больных?
Сосудистая теория Вирхова предполагает, что язвообразованию должно предшествовать нарушение кровоснабжения стенок желудка или 12-перстной кишки. В определенных условиях сосудистый фактор играет существенную роль в генезе язвообразования.
Во многом и сейчас остается актуальной пептическая теория, разработанная Квинке. Суть ее заключается в том, что для образования язвы желудка определяющее значение имеет повышение кислотности и переваривающей силы желудочного сока. Однако против абсолютного принятия этой теории имеются два возражения: 1) у ряда больных кислотность нормальная или даже сниженная и 2) у большого количества лиц, несмотря на резко повышенную кислотность и переваривающую силу желудочного сока язва не развивается.
Несомненного внимания заслуживает кортико-висцеральная теория, разработанная К.М. Быковым и И.Т Курциным. Согласно этой теории развитие язвенной болезни представляется как органное проявление коркового невроза, возникающее вследствие перенапряжения и нарушения динамического равновесия основных нервных процессов – возбуждения и торможения, с развитием очага патологической доминанты в структурах, непосредственно участвующих в регуляции секреторной деятельности желудка.
Каждая из перечисленных выше теорий вносит определенный вклад в понимании общих патогенетических путей язвообразования, не являясь, однако, исчерпывающей, то есть охватывающей все известные в настоящее время механизмы ульцерогенеза.
Поскольку язвенная болезнь – это прежде всего повреждение слизистой, то и развитие дефекта слизистой оболочки желудка или 12-перстной кишки является результатом нарушения равновесия между агрессивными факторами и защитными факторами, предупреждающими реализацию этого патогенного действия. Именно нарушение динамического равновесия между этими факторами и представляет собой конечный этап патогенеза язвообразования, а их изменения являются местными механизмами развития язвенной болезни.
Факторами защиты являются:
1. Резистентность слизистой оболочки к действию агрессивных факторов.
Она включает защитный слизистый барьер и активную регенерацию поверхностного эпителия.
Защитный слизистый барьер имеет два компонента: слой видимой нерастворимой слизи («первая линия защиты») и слой эпителиальных клеток слизистой оболочки («вторая линия защиты»).
Основной задачей этого слоя является создание защитного барьера против проникновения водородных ионов и пепсиногена вглубь слизистой оболочки желудка и ДПК.
Под слоем защитного геля находятся бикарбонаты, секретируемые клетками эпителия слизистой оболочки желудка. Эти бикарбонаты также противодействуют проникновению ионов Н+ в слизистую оболочку желудка.
Под слоем слизи располагается слой поверхностного эпителия; эти два слоя тесно связаны между собой коллоидными тяжами.
Слизисто-бикарбонатный барьер (т.е. слой слизи и расположенные под ним бикарбонаты) является основным компонентом цитопротекции – то есть защиты эпителия слизистой оболочки. Секреция бикарбонатов идет параллельно секреции НСL: чем больше продуцируется НСL (и, следовательно, водородных ионов Н+), тем больше бикарбонатов вырабатывается клетками слизистой оболочки. Продукция и НСL (Н+), и бикарбонатов регулируется блуждающим нервом, при этом влияние блуждающего нерва на продукцию НСL реализуется через М2-холинорецепторы, а регуляция выработки бикарбонатов – через М1-холинорецепторы.
При ЯБ защитный слизисто-бикарбонатный барьер нарушается: снижается общая продукция слизи, меняется её качественный состав (снижается содержание в слизи фукогликопротеидов), снижается секреция бикарбонатов. Указанные изменения способствуют проникновению Н+ в слизистую оболочку желудка, что сопровождается нарушением активной регенерации поверхностного эпителия слизистой оболочки. Нарушение регенерации поверхностного эпителия слизистой оболочки предрасполагает к язвообразованию и является, таким образом, важным патогенетическим фактором ЯБ.
К защитным факторам, определяющим резистентность слизистой желудка и 12-перстной кишки, следует отнести и ее способность к активной регенерации. В физиологических условиях железистый аппарат желудка полностью обновляется приблизительно в течение каждых пяти суток. Таким образом, если слизистая оболочка обладает способностью к активной регенерации, а агрессивные свойства желудочного сока не повышены, то даже обширные острые повреждения слизистой не вызывают образования язв.
Одним из защитных факторов, предупреждающих повреждение слизистой, является антродуоденальное торможение выделения кислоты, которое наблюдается при снижении внутриантрального и внутридуоденального рН до 2,0 – 2,5. Этот эффект реализуется за счет нервных и гуморальных механизмов, изменение которых у больных язвенной болезнью может приводить к тому, что торможение кислотообразования происходит при значительно более низких значениях рН, чем у здоровых людей.
2. Адекватное кровоснабжение слизистой.
Оптимальное кровоснабжение является обязательным условием для нормальной регенерации эпителия, нормального состояния защитного слизистого барьера и резистентности слизистой оболочки желудка и ДПК. При ухудшении кровоснабжения возникает ишемия слизистой оболочки и агрессивные факторы легко реализуют свое ульцерогенное влияние.
3. Нормальное содержание простагландинов в стенке слизистой оболочки.
Считается, что простагландины (Е2) обеспечивают надежную устойчивость гастродуоденальной слизистой оболочки благодаря их способности ингибировать выработку НСL, стимулировать слизеобразование и продукцию щелочного компонента желудочного сока, повышать уровень кровотока в слизистой оболочке и её регенераторной потенции. Простагландины могут секретироваться главными, добавочными и обкладочными (париетальными) клетками.
4. Иммунная защита.
У больных язвенной болезнью выявляется дефицит секреторного IgA, выполняющего защитную функцию в отношении слизистых оболочек, а также признаки вторичного иммунодефицитного состояния, которое выражается в выраженной депрессии местного гуморального иммунитета (снижение IgG и IgA в слюне), дисбалансе общего гуморального звена иммунитета (повышение IgG в сыворотке крови), а также в понижении неспецифической резистентности организма (снижение фагоцитарной функции нейтрофилов).
Конкретные данные о содержании Т и В-лимфоцитов, иммуноглобулинов оказываются, как правило, противоречивыми. Поэтому вопрос о роли иммунных нарушений в патогенезе ЯБ окончательно не решен.
К факторам агрессии относятся:
1. Усиление воздействия ацидо-пептического фактора, связанное с увеличением массы секреторных клеток и увеличением продукции соляной кислоты и пепсина.
2. Нарушение моторно-эвакуаторной функции желудка и двенадцатиперстной кишки (задержка или ускорение эвакуации кислого содержимого из желудка, дуоденогастральный рефлюкс).
Ослабление моторики желудка приводит к стазу его содержимого, растяжению антрального отдела и гиперпродукции гастрина. Это приводит к желудочной гиперсекреции, в результате создаются предпосылки для возникновения язвы.
При ускорении моторно-эвакуаторной функции желудка создаются условия для интенсивного поступления кислого желудочного содержимого в ДПК и длительного его контакта со слизистой оболочкой кишки. В то же время при наличии недостаточной ощелачивающей способности содержимого ДПК возникают условия для действия агрессивных факторов желудочного сока с последующим возможным образованием дуоденальной язвы.
С другой стороны, нарушение моторной функции 12-перстной кишки с развитием дуоденогастрального рефлюкса (ДГР) сопровождается забрасыванием содержимого ДПК в желудок. Это содержимое оказывает агрессивное воздействие на слизистую оболочку желудка. Смесь желчи с панкреатическим соком приводит к образованию лизолецитина, который токсически влияет на клетки слизистой оболочки желудка, повреждая её. Сама желчь также непосредственно оказывает повреждающее влияние на слизистую оболочку. Под влиянием дуоденального содержимого страдает защитный барьер, увеличивается обратная диффузия ионов Н+, что приводит к образованию язвы.
3. В настоящее время большое значение в патогенезе ЯБ, особенно дуоденальной язвы, придается инфекционному агенту - Helicobacter pylori (H. pylori). В 1983 г австралийские исследователи В. Marshall и J. Warren описали новую бактерию Helicobacter (Campylobacter) pylori, выделенную из слизистой оболочки пилорического отдела желудка больных, страдавших хроническим гастритом. Впоследствии Н. pylori был обнаружен и у больных ЯБ. Ранее полагали, что в желудке в связи с бактерицидными свойствами кислого желудочного сока невозможна длительная персистенция бактерий. Оказалось, что это не так: благодаря небольшим размерам генома и уникальной способности к видоизменениям (мутациям) НР сумели адаптироваться к резко кислой среде желудка и занять свободную «экологическую» нишу.
Излюбленным местом колонизации НР является антральный отдел слизистой оболочки желудка, где для этого имеются оптимальные условия (более высокий уровень рН), но впоследствии возможна их экспансия в антрокардиальном направлении (при снижении продукции Н+ ионов фундальными железами желудка). Ни цилиндрический эпителий кишечника, ни многослойний плоский эпителий пищевода НР колонизировать не могут.
Большинство инфицированных НР (более 70%) на протяжении всей жизни остаются здоровыми бактерионосителями без развития каких-либо патологических процессов. Многие авторы высказывают обоснованное суждение, что НР - это комменсалы («сотрапезники»), являющиеся составной частью нормобиоценоза человека, а приобретение некоторыми штаммами НР вирулентных (цитотоксических) свойств результат возникших мутаций, обусловленных изменениями экологии внешней среды, применением антибактериальных средств, многочисленными стрессами. Следовательно, возникновение вирулентных штаммов НР имеет ятрогенное происхождение.
В то же время, эпидемиологические данные, полученные в различных странах, свидетельствуют о том, что практически 100% язв, локализованных в ДПК, и более 80% язв желудочной локализации связаны с персистированием Нelicobacter pylori. Этот микроорганизм хорошо адаптирован к неблагоприятной среде обитания в желудке и способен выделять патогенные для желудка вещества.
Бактерии могут прикрепляться к мембранам эпителиальных клеток желудка благодаря наличию специфических адгезинов, на что макроорганизм отвечает воспалительной реакцией. Клеточным субстратом иммунного воспаления являются мононуклеары - источники продукции провоспалительных цитокинов (интерлейкина 1β и 8, γ-интерферона и фактора некроза опухоли-α и др.). В очаг воспаления из кровеносных сосудов мигрируют лейкоциты, которые вырабатывают активные формы кислорода, повреждающие желудочный эпителий. Воспалительно измененная слизистая оболочка становится более чувствительной к воздействию кислотно-пептического фактора.
Сам Н. pylori имеет ферменты адаптации (уреазу, каталазу, супероксиддисмутазу), позволяющие ему выжить в кислой среде желудка. Уреаза, выделяемая микробом, вызывает превращение мочевины в углекислый газ (СО2) и аммиак (NH3), что локально нейтрализует рН. Выделение каталазы и супероксиддисмутазы позволяет Н. pylori подавлять клеточный иммунный ответ макроорганизма, прежде всего защищаться от лейкоцитов. Эти ферменты катализируют реакцию обезвреживания бактерицидных свободных радикалов кислорода, которые выделяются нейтрофилами в ответ на инфекцию.
Выработка токсинов является важным механизмом патогенного воздействия Н. pylori. В последние годы выделены штаммы Н. pylori, имеющие гены, экспрессирующие цитотоксин-ассоциированный белок - CagA (cagA Ia фенотип), вакуолизирующий цитотоксин - VacA (vacA Ib фенотип) или оба белка одновременно (фенотип I), которые ответственны за развитие тяжелых гастритов, лимфомы (МАLТомы) желудка и являются факторами риска рака желудка. К патогенным относят также штаммы Н. pylori, продуцирующие протеины IceA и ВаdА. Установлен мультигенный локус, называемый «островком патогенности» - cag PAI (the cag pathogenicity island), который определяет вирулентность Н. pylori. Цитотоксическая активность выше у тех микроорганизмов, которые получают от больных с дуоденальными язвами.
Роль Н. pylori в развитии язвы двоякая: с одной стороны, в процессе своей жизнедеятельности, образуя аммиак из мочевины, Н. pylori постоянно защелачивает антральный отдел желудка, что приводит к гиперсекреции гастрина, постоянной стимуляции обкладочных клеток и гиперпродукции НСl, что может стать предпосылкой к развитию язвенной болезни. Одновременно уменьшается количество D-клеток, которые продуцируют соматостатин, ингибирующий кислотообразование в желудке, нарушается целостность слизисто-бикарбонатного барьера и эпителиального покрова желудка с образованием пристеночных тромбов в микрососудах слизистой оболочки желудка, ухудшается микроциркуляция вплоть до возникновения очаговых микроинфарктов. В результате этих патологических процессов, обусловленных действием вирулентных штаммов НР, повышаются агрессивные свойства желудочного сока и снижаются защитные потенции слизистой оболочки желудка.
Кроме того, под влиянием НР уменьшается количество клеток, экспрессирующих интерлейкин - 4, который действует как противовоспалительный цитокин и тормозит синтез ИЛ – 1, фактора некроза опухоли – альфа. В то же время антигены НР активируют макрофаги собственной пластинки слизистой желудка, а последние в свою очередь стимулируют образование провоспалительных цитокинов типа ИЛ – 1, фактор некроза опухоли – альфа и ИЛ – 8. Таким образом, внедрение НР – инфекции в слизистую оболочку желудка изменяет иммунный ответ организма, который приобретает провоспалительный характер, а образующиеся провоспалительные цитокины усиливают продукцию гастрина и гистамина, при этом резко нарастает кислотность желудочного сока и создаются условия для образования язвы.
Таким образом, в основе патогенеза ЯБ лежит нарушение динамического равновесия между факторами агрессии и защиты слизистой оболочки или 12-перстной кишки. В общем виде роль этих факторов представлена ниже на рисунке.
|







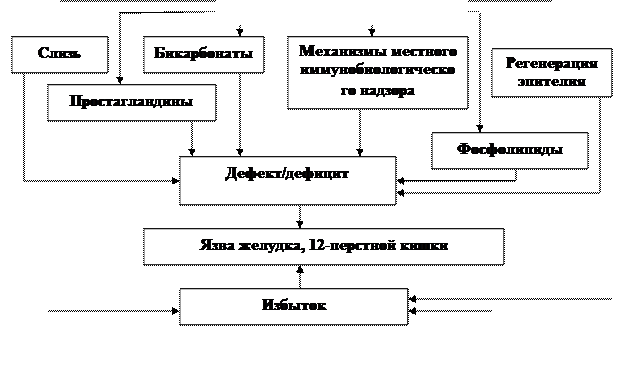
 |  | ||
Рис. Роль факторов агрессии и защиты в развитии язвенной болезни.
 При этом важно отметить, что многие из указанных факторов агрессии и защиты генетически детерминированы, а равновесие между ними поддерживается согласованным взаимодействием нейроэндокринной системы (рисунок ниже).
При этом важно отметить, что многие из указанных факторов агрессии и защиты генетически детерминированы, а равновесие между ними поддерживается согласованным взаимодействием нейроэндокринной системы (рисунок ниже).
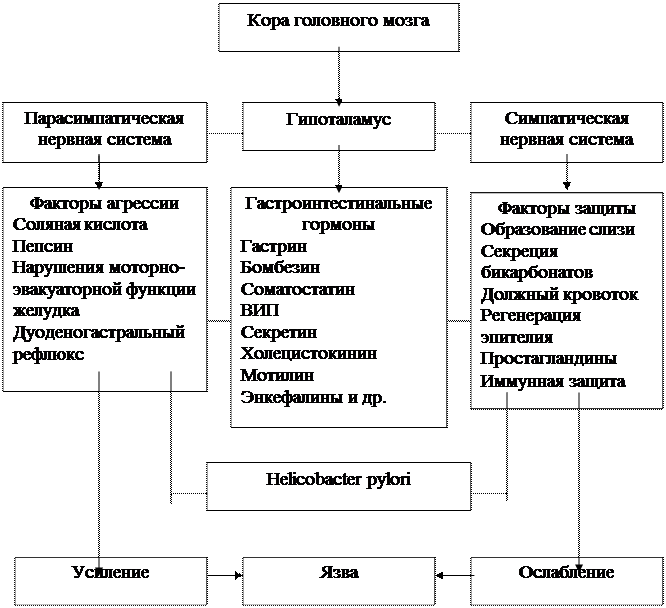
Рис. Основные патогенетические механизмы язвообразования.
Центральным звеном регуляции является гипоталамус, который преимущественно через парасимпатическую нервную систему влияет на ацидо-пептический фактор, а через симпатическую - на трофические (защитные) процессы. Кроме того, гипоталамус контролирует работу гастроинтестинальных гормонов, имея в своем составе клетки, продуцирующие соответствующие гормоны.
Регулирующая роль гастроинтестинальных гормонов многообразна и многопланова. Такие гормоны, как гастрин, бомбезин, а также гистамин, усиливают секрецию соляной кислоты желудком. В то же время гастрин не только усиливает агрессивные свойства желудочного сока, но и положительно влияет на трофику слизистой оболочки, т.е. усиливает защитные факторы. Соматостатин тормозит желудочную секрецию, блокируя выделение G-клетками гастрина. Секретин же в ответ на закисление ДПК увеличивает объем продукции бикарбонатов поджелудочной железой, повышая рН в просвете кишки. Гиперпродукция гастрина или гистамина может приводить к возникновению гастродуоденальных язв (синдром Золлингер -Эллисона, мастоцитоз).
Таким образом, язвенная болезнь – это многофакторное заболевание и в ее патогенезе принимают участие генетические особенности макроорганизма, внешнесредовые факторы, а также инфицирование слизистой оболочки желудка НР. Схема общего патогенеза язвенной болезни представлена на рисунке 6.
Дата добавления: 2014-12-29; просмотров: 4202;
