Решение ОВР с учетом характера среды
Рассмотрим принцип влияния химической среды на примере окислительно-восстановительной реакции, которая имеет разные продукты в зависимости от химической среды раствора.
Кислая среда
KMn+7O4 + NaN+3O2 + H2SO4 → NaN+5O3 + Mn+2SO4 + K2SO4 + H2O
Степень окисления изменяют марганец Mn+7, который входит в состав реально существующего иона MnO4- и является типичным окислителем, и азот N+3, который входит в состав иона NO2- и является восстановителем.
Схема реакции восстановления: MnO4- + 5e → Mn2+.
Данная схема показывает форму существования марганца до и после восстановления, но не учитывает атомы кислорода, которые в левой части полуреакции входят в состав перманганат-иона MnO4- , а в правой части - их нет. Для связывания атомов кислорода в кислой среде используют катионы водорода H+, причем для связывания одного атома кислорода необходимо два катиона водорода – получаем молекулу воды: О-2 + H+ = H2O.
В данной реакции необходимо связать четыре атома кислорода, поэтому надо взять 8H+ и первую полуреакцию запишем:
MnO4- + 5e + 8H+ = Mn2+ + 4H2O.
Схема реакции окисления: NO2- - 2e → NO3-.
В левой части два атома кислорода, а в правой – три. В кислой среде недостающий кислород берем из молекул воды H2O, полуреакция принимает вид:
NO2- - 2e + H2O = NO3- + 2Н+.
На основании двух полуреакций составим электронно-ионный баланс.
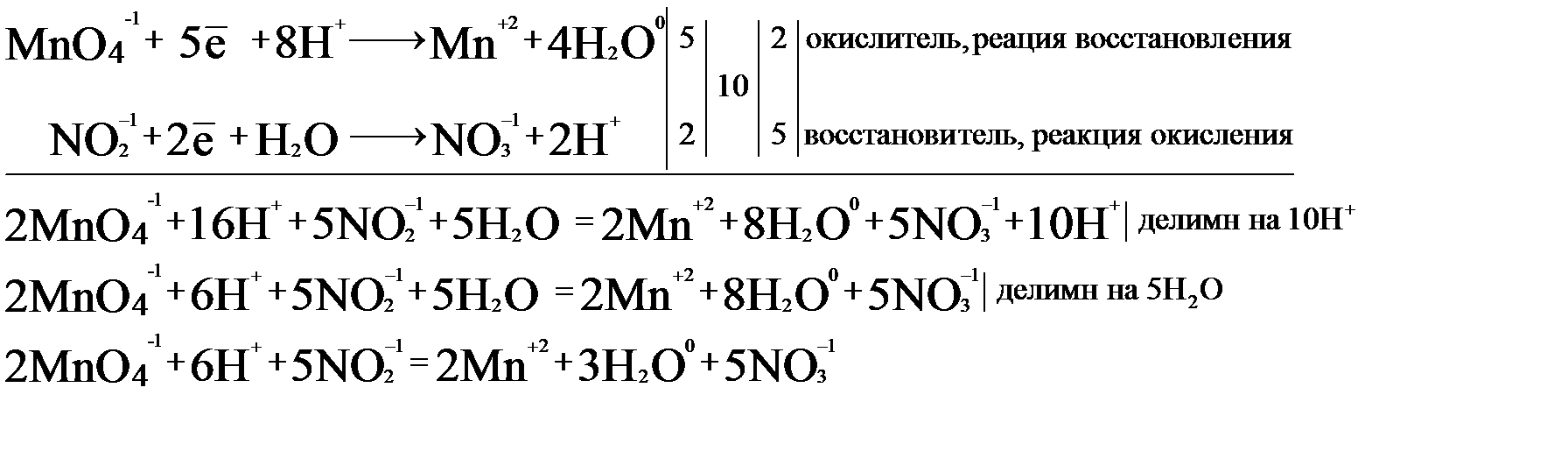
16H+ в левой части уравнения и 10H+ в правой, поэтому, вычитая, получим в результате 6H+ (16H+ -10H+ = 6H+). Такое же действие проводим с молекулами воды (5H2O – 8H2O = 3H2O). В правой части остаются 3 молекулы воды. Исходя из полученного баланса, расставляем коэффициенты в уравнение:
2KMnO4 + 5NaNO2 + 3H2SO4 = 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
Щелочная среда
KMn+7O4 + NaN+3O2 + NaОН → К2Mn+6O4 + Na2Mn+6O4 + NaN+5O3 + H2O.
Степень окисления изменяют марганец Mn+7, который входит в состав реально существующего иона MnO4- и является типичным окислителем, и азот N+3, который входит в состав иона NO2- и является восстановителем.
Схема реакции восстановления: MnO4- + 1e → MnO42-..
В данном случае при переходе марганца из перманганат-иона MnO4- в манганат-ион MnO42- атомный состав кислотного остатка не меняется, изменяется только его заряд. Поэтому никаких дополнительных действий производить не надо.
Схема реакции окисления: NO2- - 2e → NO3-.
Состав кислотного остатка в восстановителе изменяется – увеличивается на один атом кислорода. В щелочной среде недостающий кислород берем из гидроксогрупп, причем на каждый требующийся кислород необходимо взять две гидроксогруппы: 2ОН- = О-2 + H2O. С учетом вышесказанного вторая полуреакция приобретает вид:
NO2- - 2e + 2OH- = NO3- + H2O.
На основании двух полуреакций составим электронно-ионный баланс.
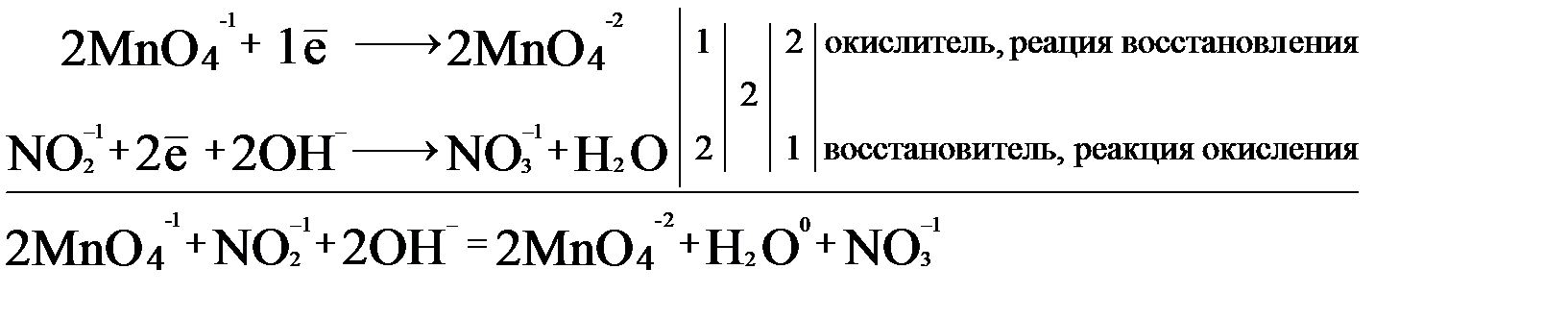
Исходя из полученного баланса, расставляем коэффициенты в уравнение:
2KMnO4 + NaNO2 + 2NaOH = K2MnO4 + Na2MnO4 + NaNO3 + H2O.
Нейтральная среда
KMn+7O4 + NaN+3O2 + H2O → Mn+4O2↓ + NaN+5O3 + KOH.
Степень окисления изменяют марганец Mn+7, который входит в состав реально существующего иона MnO4- и является типичным окислителем, и азот N+3, который входит в состав иона NO2- и является восстановителем.
Схема реакции восстановления: MnO4- + 3e → MnO2 .
В перманганат-ионе присутствуют четыре атома кислорода, а в диоксиде марганца MnO2 всего два атома кислорода. Поэтому надо связать кислород, высвобождающийся в реакции. Для связывания атомов кислорода в нейтральной среде используют молекулы воды, причем молекула воды присоединяет атом кислорода и превращается в две гидроксогруппы: О-2 + H2O = 2ОН-.
В данной реакции необходимо связать два атома кислорода, поэтому надо взять две молекулы воды: MnO4- + 3e + 2Н2О = MnO2 + 4OH-.
Схема реакции окисления: NO2- - 2e + H2O → NO3- + 2Н+.
Состав кислотного остатка в восстановителе изменяется – увеличивается на один атом кислорода. В нейтральной среде недостающий кислород берем из молекул воды, при этом высвобождается два катиона водорода: H2O = О-2 + 2Н+ .
Полуреакция окисления: NO2- - 2e + H2O = NO3- + 2Н+ .
На основании двух полуреакций составим электронно-ионный баланс.
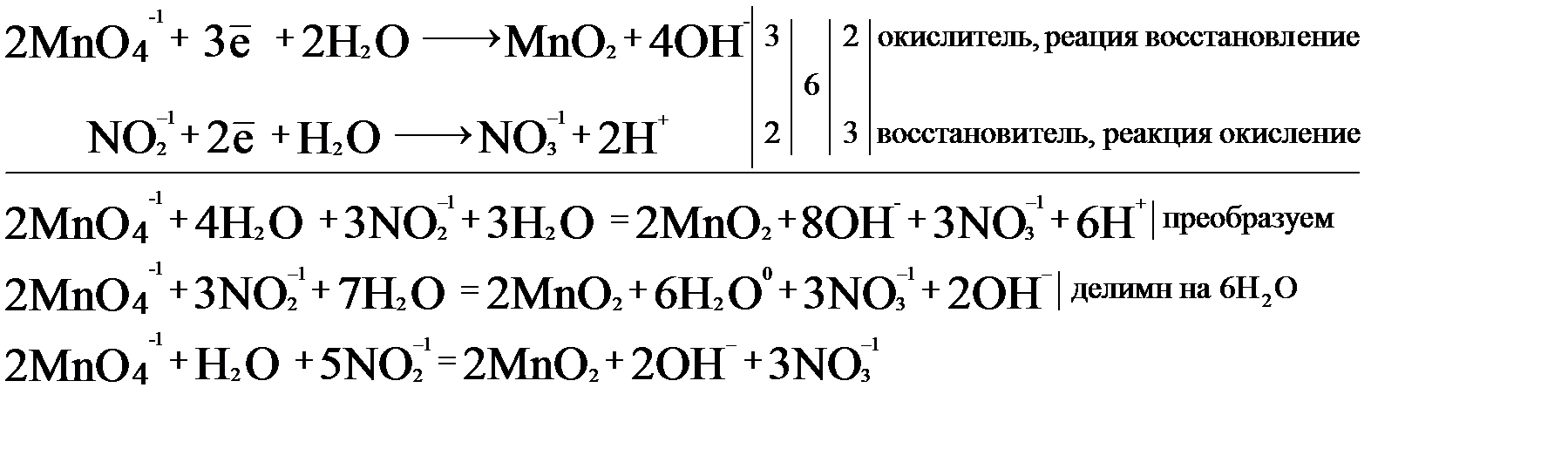
Исходя из полученного баланса, расставляем коэффициенты в уравнение:
2KMnO4 + 3NaNO2 + H2O = 2MnO2↓ + 3NaNO3 + 2KOH.
Обычно, правильность расстановки коэффициентов в уравнении определяют по равенству атомов кислорода в левой и правой частях уравнения реакции. В данной реакции кислорода по 15 атомов в обеих частях уравнения.
Дата добавления: 2019-04-03; просмотров: 2175;
