Типичные окислители и восстановители
Рассмотрим, какие атомы и молекулы чаще проявляют окислительные, а какие - восстановительные свойства.
Типичные окислители:
- неметаллы в свободном виде, например, галогены (F2, Cl2, Br2, I2), кислород, сера и др.
- кислородсодержащие кислоты и соответствующие им оксиды, например: HNO3, H2SO4(конц), H2CrO4, N2O5, Mn2O7, CrO3 и др.
- соли кислородсодержащих кислот преимущественно в высшей степени окисления атома кислотообразующего элемента, например, KMnO4 ( Mn+7 ), K2Cr2O7 (Cr+7), Pb(ClO4)2 (Cl+7) и др. Следует отметить, что кислоты являются более сильными окислителями, чем их соли.
- катионы металлов в высшей степени окисления, например, Sn4+, Cu2+, Fe3+, Hg2+, Pb4+.
Типичные восстановители:
- металлы в виде простых веществ. Например: Fe0, Zn0 , АI0 и т.д.
- катионы металлов в низшей степени окисления Sn2+, Fe2+, Pb2+ и т.д.
- кислородосодержащие кислоты и их оксиды преимущественно в низшей степени окисления атома кислотообразующего элемента. Например: H2SO3, HNO2, H3РO3, H3PO2, NO2, SiO2 и т.д.
- бескислородные кислоты и их соли, в которыхкислотообразующий элемент проявляет низшую степень окисления. Например: НI, KI, Н2S, Na2S и т.д.
Таким образом, можно отметить, что соединения, содержащие атомы элементов в высшей степени окисления (Mn+7, CI+7, S+6, Cr+6, N+5, Pb+4 и т.д.) могут быть в окислительно-восстановительных реакциях только в качестве окислителей. Соединения, содержащие атомы элементов в низшей степени окисления (S-2, Br-1, I-1, CI-1,N-3 и т.д.), могут быть только восстановителями.
Если вещества содержат в своем составе атомы элементов в промежуточной степени окисления, то они могут проявлять окислительно-восстановительную двойственность. Так, нитрит натрия NaNO2является восстановителем по отношению к сильным окислителям (KMnO4, K2Cr2O7) и окислителем по отношению к типичным восстановителям (Na2S, KI). Например:
а) 2К I + 2КNO2 + 2 H2SO4 = 2NO + I2 + 2K2SO4 + 2H2O
2I- - 2ē = I2, I - - восстановитель,
N+3 + 1ē = N+2 , N+3 - окислитель.
б) 5КNO2 + 2KMnO4 + 3H2SO4 = 5КNO3 +2MnSO4 + K2SO4 + 3H2O
N+3 - 2ē = N+5 , N+3 – восстановитель,
Mn+7 + 5ē = Mn+2 , Mn+7 - окислитель.
Аналогично ведет себя пероксид водорода H2O2 ,где у кислорода промежуточная степень окисления +1. Одна молекула H2O2 проявляет окислительные свойства, а другая- восстановительные:
- в роли окислителя H2O2 + 2ē + 2H 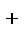 = 2H2O,
= 2H2O,
- в роли восстановителя H2O2 - 2ē = O2 + 2H 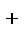 .
.
Дата добавления: 2019-04-03; просмотров: 7103;
