Электролитическая диссоциация
В зависимости от характера химической связи в веществе оно может переходить в жидкий растворитель в виде атомов, молекул или ионов. В растворителе эти частицы подвергаются сольватации (гидратации). Дальнейшая судьба сольватированных молекул и ионов может быть различной. Молекулы могут диссоциировать на ионы, а ионы рекомбинировать с образованием молекул.
Если перешедшие в жидкость молекулы растворяемого вещества и молекулы (частицы) растворителя полярны, то сольватированные молекулы растворяемого вещества в результате взаимодействия с молекулами растворителя с большой вероятностью диссоциируют на положительные и отрицательные ионы (катионы и анионы соответственно): АВ ® A+ + B-.
Наличие ионов в растворе делает его электропроводящим, т. е. электролитом. Поэтому такой процесс образования ионов в растворе называется электролитической диссоциацией. В дальнейшем будем называть ее просто диссоциацией. Большая часть водных растворов неорганических веществ с ионным или ковалентным полярным типом связи (основания, кислоты, соли) является электролитами.
Если ионов в растворе нет, то он не проводит электрический ток и является неэлектролитом. Примером могут служить растворы, образованные неполярными органическими и неорганическими молекулами, такие как раствор бензола в толуоле, сахара в воде и т.д.
Наличие в растворе противоположно заряженных ионов, независимо от способа их образования, обусловливает вероятность их рекомбинации (ассоциации) с образованием молекул: A+ + B- ® AB.
Таким образом, процесс электролитической диссоциации является обратимым. Скорости диссоциации и рекомбинации зависят от концентрации частиц и их природы. Отметим, что для простоты мы рассматриваем молекулы и ионы как частицы, не имеющие сольватной оболочки. В реальных условиях сольватная оболочка влияет на скорости процессов.
В результате в растворе установится состояние динамического равновесия, при котором скорости диссоциации и рекомбинации равны и определенная часть растворенного вещества будет находиться в виде ионов, а оставшееся количество – в виде молекул. Равновесие, в зависимости от концентрации и природы веществ, может быть сдвинуто в сторону либо диссоциации, либо рекомбинации. Таким образом, в одних растворах будут преобладать ионы, а в других – молекулы.
Соотношение количеств растворенного вещества, находящегося в виде ионов и в виде молекул, характеризуется степенью диссоциации. Степень диссоциации (a) будет равна отношению числа молекул, находящихся в растворе в виде ионов (Nд), к общему числу молекул растворенного вещества (N0). Она равна соответственно отношению их молярных концентраций (Сди С0):
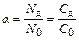 .
.
Степень диссоциации часто выражается в процентах. В зависимости от величины степени диссоциации электролиты условно делятся на сильные (a >50%), слабые, (a <5%) и средние (5%< a <50%). Деление весьма условно, так как степень диссоциации сильно зависит от концентрации растворенного вещества.
Для состояния равновесия существует константа равновесия, которая в данном случае называется константой диссоциации (Кд). Пусть реакция диссоциации описывается уравнением AB ↔ A+ + B-. Тогда выражение для константы диссоциации имеет вид
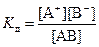 ,
,
где [A+], [B-], [AB] – равновесные молярные концентрации соответствующих частиц.
Для учета неидеальности реальных растворов вместо концентраций соответствующих частиц в выражении константы равновесия используются их активности аi =gi×Сi, где gi – коэффициент активности (см. химический потенциал). Отметим, что для оценочных расчетов равновесия разбавленных растворов можно принять gi×= 1. В случае растворов электролитов величина коэффициента активности может значительно отличаться от единицы.
Пример.
Средние ионные коэффициенты активности g± сильных электролитов в водных растворах при Т0=298 К
| Электролит | Концентрация электролита, моль/кг воды | |||
| 0,001 | 0,01 | 0,1 | ||
| HCl | 0,965 | 0,904 | 0,796 | 0,809 |
| NaOH | - | 0,905 | 0,766 | 0,678 |
| NaCl | 0,965 | 0,903 | 0,778 | 0,657 |
На практике для оценки активности ионов пользуются средним значением активностей (а±) и коэффициентов активности (g±) ионов данного электролита: а± = g±×m± , m± = 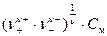 ,
,
где m± – средняя ионная моляльная концентрация; См – моляльная концентрация растворенного вещества (число молей растворенного вещества содержащихся в 1 кг растворителя); n+ ,n- – число катионов и анионов в молекуле электролита, n =n+ + n-.
Средние ионные коэффициенты активности g±, приведены в справочной литературе.
Величину коэффициентов активности в разбавленных растворах также, согласно теории ионных растворов Дебая-Хюккеля (Debye, Hückel), можно рассчитать по ионной силе раствора (I): 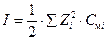 ,
,
где Смi – моляльная концентрация и Zi – заряд i-го иона в растворе.
Для разбавленных водных растворов при Т0=298 К коэффициент активности ионов может быть аппроксимирован выражением
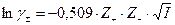 .
.
Поскольку равновесие в растворе может быть описано как степенью, так и константой диссоциации, то они должны быть связаны между собой. Отметим, что величина Кдне зависит, а величина a зависит от концентрации растворенного вещества.
Согласно уравнению реакции, концентрации катионов и анионов равны между собой и соответственно равны концентрации вещества, находящегося в растворе в виде ионов: [A+] = [B-] = Cд. Тогда концентрация вещества АВ, находящегося в недиссоциированной форме, [AB] = C0– Cд. Поскольку a = Сд/С0, то Сд=a×C0 и
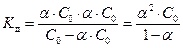 .
.
Величины Кд для различных электролитов лежат в широких пределах, например, для HNO2 Кд=6,9×10-4, а для HCl Кд=1×107.
Если Кд® 0, то a ® 0. В этом случае a <<1 и Kд »a2×C0. Тогда a» 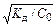 . Поскольку Kд – величина постоянная, то степень диссоциации растет с уменьшением концентрации растворенного вещества. Эта зависимость известна как закон разбавления Оствальда (Ostwald). С увеличением константы диссоциации соответственно увеличивается степень диссоциации и для сильных электролитов a ® 1.
. Поскольку Kд – величина постоянная, то степень диссоциации растет с уменьшением концентрации растворенного вещества. Эта зависимость известна как закон разбавления Оствальда (Ostwald). С увеличением константы диссоциации соответственно увеличивается степень диссоциации и для сильных электролитов a ® 1.
Если молекула электролита содержит несколько однотипных ионов, то ее диссоциация протекает ступенчато, например:
A2B ↔ A+ + АB- 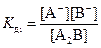 ,
,
AB- ↔ A+ + B2- 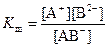 .
.
Каждая ступень характеризуется своим значением константы диссоциации (Кд1, Кд2). При расчете состава раствора необходимо учитывать диссоциацию по обеим ступеням.
Дата добавления: 2017-02-20; просмотров: 1485;
