Равновесия в растворах
Растворы
Раствор является гомогенной однофазной многокомпонентной системой переменного состава, образованной двумя или более веществами, которые, как правило, подразделяют на растворитель и растворенное вещество. Растворителем считается то вещество, которое в чистом виде находится в такой же фазе, что и раствор. Если раствор образуют два вещества в одной фазе (например, две жидкости), то растворителем обычно считают то вещество, которого больше (в мольных долях). Если одним из веществ, образующих раствор является вода, то ее всегда считают растворителем. По агрегатному состоянию растворителя растворы делятся на газовые, жидкие и твердые.
Одним из способов получения растворов является растворение вещества в растворителе. Растворение – процесс образования однофазной многокомпонентной системы из многофазной.
Различают физическое и химическое растворение.
Физическое растворение – переход вещества в раствор, не сопровождающийся изменением химического состава. Вследствие этого растворенное вещество может быть вновь выделено из раствора путем изменения какого либо внешнего параметра. Например, понижение давления или повышение температуры приводит к выделению из жидкости растворенных газов.
Химическое растворение – переход вещества в раствор, который сопровождается реакцией, приводящей к изменению химического состава растворенного вещества. В этом случае растворенное вещество не может быть выделено из раствора путем изменения внешних параметров системы. Например, при растворении металла в кислоте образуется раствор его соли. Изменением только температуры нельзя выделить металл из раствора.
Растворимостью вещества называется максимально возможная его концентрация в растворе при данных условиях (температура, давление). Она характеризует способность вещества переходить в растворитель с образованием раствора. Если не достигнута величина растворимости, то раствор называется ненасыщенным. При достижении растворимости между раствором и веществом устанавливается динамическое равновесие, раствор называется насыщенным.
Важную роль при образовании растворов играют химические связи как в растворителе, так и в растворяемом веществе. В газах межмолекулярные взаимодействия невелики, поэтому при невысоких давлениях они смешиваются друг с другом в любых соотношениях, их взаимная растворимость является неограниченной. В твердом состоянии вещества образуют растворы, если частицы растворяемого вещества могут встраиваться в кристаллическую решетку растворителя. При этом необходимо выполнение, по крайней мере, двух условий. Во-первых, геометрические размеры частиц растворителя и растворенного вещества не должны сильно различаться. Во-вторых, частицы растворенного вещества должны образовывать химические связи с частицами растворителя. Эти условия выполняются, например, при образовании сплавов металлов.
В жидкости частицы связаны между собою силами межмолекулярного взаимодействия и водородными связями. При описании свойств жидких растворов необходимо учитывать взаимодействия между частицами растворителя, частицами растворенного вещества с частицами растворителя и между частицами растворенного вещества.
Образование раствора происходит, если изменение энергии Гиббса при растворении меньше нуля (термодинамическое условие протекания изобарного процесса DG0=DH0– T DS0< 0). При достижении растворимости устанавливается равновесие (DG0=0).
При физическом растворении происходит разрушение структуры растворяемого вещества (разрушение кристаллической структуры твердого вещества, диссоциация растворенных молекул и т.д.) и сольватация частиц растворенного вещества (в случае водных растворов – гидратация). Сольватация представляет собой образование химических связей между частицами растворителя и молекулами или ионами растворенного вещества. При этом каждая частица растворенного вещества оказывается окруженной частицами растворителя, образующими сольватную оболочку (в случае водных растворов – гидратную оболочку).
Тепловой эффект растворения (DН0) будет определяться суммой изменения энтальпий разрушения структуры растворяемого вещества (DдН0) и теплового эффекта сольватации (DсН0). Разрушение структуры растворяемого вещества является эндотермическим процессом (DдН0>0), а сольватация – экзотермическим (DгидрН0< 0).
В большинстве случаев при растворении газов энтропия системы понижается (DS0<0), а при растворении твердого вещества – повышается (DS0>0).
Соотношение изменения энтальпий разрушения структуры растворяемого вещества (DдН0), теплового эффекта сольватации (DсН0) и энтропии растворения (DS0) позволяет определить термодинамическую возможность растворения, а так же растворимость и ее температурную зависимость.
Пример.
1. Растворение в воде газов, не образующих с ней химических соединений. Так как нет необходимости в разрушении структуры вещества, то DдН0»0. При растворении происходит гидратация молекул газа, и поэтому изменение энтальпии при растворении меньше нуля (DН0<0). Поскольку энтропия системы при растворении газов понижается (DS0<0), то энтропийный фактор не способствует процессу растворения. Поэтому самопроизвольное растворение газов происходит при низких температурах ( 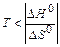 ). Растворимость газов растет при понижении температуры.
). Растворимость газов растет при понижении температуры.
2. Растворение твердых веществ в воде. Так как разрушение кристаллической решетки происходит с затратами энергии, тоDдН0>0. При растворении происходит гидратация частиц растворенного вещества (DсН0<0). Таким образом, изменение энтальпии при растворении DН0=DдН0 + DсН0может быть как отрицательным, так и положительным. Энтальпийный фактор может, как способствовать, так и препятствовать растворению. При растворении кристаллических веществ в жидкости DS0>0, поэтому повышение температуры способствует растворению.
Одной из важных характеристик раствора является концентрация, которая показывает соотношение количеств растворенного вещества и растворителя. Концентрация указывает количество растворенного вещества в единицах массы, молях, эквивалентах, объемах и др., содержащегося в массе или в объеме раствора, в массе или в объеме растворителя и т. д. Способов выражения концентрации может быть много. В химии и смежных областях науки и техники наиболее часто используются следующие.
1. Массовые концентрации – отношение количества растворенного вещества к общей массе раствора или растворителя:
массовая доля растворенного вещества – отношение массы растворенного вещества к общей массе раствора. Массовая доля, выраженная в процентах (w %), численно равна массе растворенного вещества в граммах, содержащейся в 100 г раствора;
моляльная концентрация (моляльность раствора) См – отношение количества растворенного вещества в молях (n) к массе растворителя. Моляльность раствора выражается в [моль/кг] и численно равна количеству вещества в молях, приходящемуся на 1 кг растворителя.
2. Объемные концентрации – отношение количества растворенного вещества к объему раствора:
молярная концентрация (молярность раствора) – отношение количества растворенного вещества в молях (n) к объему раствора. Молярность раствора выражается в [моль/л] и численно равна количеству растворенного вещества в молях, содержащемуся в 1 литре раствора;
нормальная концентрация (нормальность раствора) – отношение количества растворенного вещества в эквивалентах (nэ) к объему раствора. Нормальность раствора выражается в [экв/л] и численно равна количеству растворенного вещества в эквивалентах, содержащемуся в 1 литре раствора;
массовая концентрация вещества в растворе – отношение массы растворенного вещества к объему раствора [г/л] – количество растворенного вещества в г, содержащееся в 1 литре раствора.
3. Мольная (молярная) доля показывает отношение числа молей растворенного вещества n к общему числу молей в растворе. Мольная доля выражается в долях единицы или в процентах (мольный процент – моль %).
При растворении вещества в растворителе или смешивании растворов разной концентрации в результате двусторонней диффузии молекул растворенного вещества и растворителя происходит выравнивание концентрации – система приходит в состояние термодинамического равновесия.
В случае, когда растворитель и раствор или два раствора различной концентрации разделены полупроницаемой мембраной выравнивание концентраций возможно лишь при односторонней диффузии растворителя. Полупроницаемая мембрана – перегородка, пропускающая малые молекулы растворителя, но непроницаемая для более крупных молекул растворённого вещества. Диффузия всегда идёт от раствора с меньшей концентрацией (от растворителя С = 0) к более концентрированному.
Перенос растворителя через мембрану обусловлен осмотическим давлением (π). Оно равно избыточному внешнему давлению, которое следует приложить со стороны раствора, чтобы прекратить осмос. Величина осмотического давления, зависит от количества, растворенного в нём вещества, и не зависит от его химической природы. Для веществ не электролитов α→0 (см. электролитическая диссоциация):
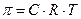 ,
,
где C – концентрация, моль/м3; R – универсальная газовая постоянная; T – температура, К.
Превышение избыточного давления над осмотическим может привести к обратной диффузии растворителя через мембрану – обратный осмос.
В случае, когда мембрана проницаема не только для растворителя, но и для некоторых растворённых веществ происходит перенос последних из раствора в растворитель – диализ.
Дата добавления: 2017-02-20; просмотров: 2983;
