ТЕМА «ХИМИЯ БЕЛКОВ».
Содержание темы:
1. Белки – природные полимеры, биологическое значение. Функции. Классификация белков, их характеристика.
2. Физико-химические свойства белков.
3. Структуры белковой молекулы, типы связи в белковой молекуле.
Белки – это высокомолекулярные соединения, состоящие из α-аминокислот – мономерных звеньев, соединенных между собой пептидными связями.
Белки, или протеины, количественно преобладают над всеми другими макромолекулами живой клетки. С белками мы встречаемся всюду, где имеет место проявление жизни. Белки участвуют во всех биологических процессах, выполняя разнообразные функции.
Основная функция белков в организме – это:
1) пластическая, т.е. они используются для построения органов и тканей животных и человека.
Белки выполняют:
2) каталитическую функцию - свыше 2000 ферментов-биокатализаторов выделено к настоящему времени. Практически все они являются белками. Химические реакции, лежащие в основе процессов жизнедеятельности, катализируются ферментами.
3) Сократительная функция - важным признаком живого является подвижность. В основе ее лежит сократительная функция белков. Например, мышечные сокращения, изменение формы клеток и субклеточных частиц.
4) Транспортная функция - белки обладают исключительными возможностями по специфическому связыванию различные соединений, например связь Нb с 02 и перенос по крови, комплекс альбумина с билирубином, что способствует обезвреживанию билирубина и др.
5) Защитная функция - белки-антитела предохраняют организм от чужеродных агентов, участвуют в выработке иммунитета.
6) Регуляторная функция - некоторые белки являются гормонами, участвуют в регуляции разнообразных процессов, протекающих в организме. Так, гормон инсулин регулирует содержание глюкозы в крови, ряд белков участвуют в регуляции осмотического давления, pH крови и т.д.
7) Белки могут использоваться и как энергетический материал (при полном окислении 1 г белка выделяется 16,9 кДж энергии).
Каждый белок имеет уникальную, свойственную лишь ему структуру и в такой же мере уникальную функцию, отличающую от функций других белков.
По своему элементарному составу белки характеризуются наличием C, O, H, N, S и часто P. Процентное содержание отдельных элементов в белковых веществах: C – 50,6-54,5%; O – 21,5-23,5%; H – 6,5-7,3%; N – 15,0-17,6%; S – 0,3-2,5%. Обычно среднее содержание азота в белке принимают равным 16%. В полном окислении едицинском вузеских исследований.ве теоретичес связи с этим:
Элементарный состав белков
С – 50,6-54,5 %
О – 21,5-23,5%
Н – 6,5-7,3%
N – 15,0-17,6 % среднее содержание – 16 %
S – 0,3-2,5%.
Содержание белка в тканях различных органов
| Ткань | Содержание белка в % от сухой массы ткани | Ткань | Содержание белка в % от сухой массы ткани |
| Селезёнка | Головной мозг | ||
| Лёгкие | Кишечник | ||
| Мышцы | Кожа | ||
| Почки | Кости | ||
| Сердце | Зубы | ||
| Печень | – | – |
Зная, что один грамм азота содержится в 6,25 г белка, находят количество азота, умножают на коэффициент 6,25 и получают количество белка.
В основе классификации белков лежат их химические и физические свойства, а также биологическая роль, которую они выполняют в организме. Все белковые вещества разделяются на 2 большие группы: простые белки – протеины и сложные – протеиды. По форме белковой молекулы белки делятся на глобулярные (шаровидные) и фибриллярные (нитевидные). По растворимости в воде выделяют водорастворимые, солерастворимые, нерастворимые в воде (характерны для биологических мембран).
Водорастворимые простые белки имеют глобулярную форму. Они находятся в биологических жидкостях, выполняют транспортные функции, являются ферментами и т.д.
Водонерастворимые простые белки имеют форму нитей. Это фибриллярные белки. Они выделены из кожи, костей, сухожилий и др. Типичный белок такого типа – коллаген.
Простые белки при гидролизе образуют только аминокислоты. Простые белки разделяются на альбумины и глобулины, протамины и гистоны и др.
Альбумины – в крови, спинномозговой жидкости, а также в клетках всех животных, растений и микроорганизмов. Хорошо растворимы в воде, отличаются от глобулинов незначительным содержанием глицина, 15% лейцина. Содержат много серосодержащих аминокислот. Альбумины – мелкодисперсные молекулы, окружены большой водной оболочкой, легко вступают в связь с различными веществами с образованием комплексов (альбумин-билирубиновый и др.). Обеспечивают кислотные свойства. Альбумины участвуют в поддержании осмотического давления крови (создают онкотическое давлении), транспортируют с кровью различные вещества.
Водорастворимые белки, осаждаются сульфатом аммония при 100% насыщении. В плазме крови человека и животных альбумины составляют 50% от всех белков; в белке яиц овальбумина – до 50% в молоке – лактальбумин; альбумино – подобными белками богаты растения. Поддерживают онкотическое давление и осуществляют транспорт многих веществ, включая ксенобиотики.
Глобулины – почти всегда встречаются вместе с альбуминами. Они растворимы в воде и легко растворяются в солевых растворах слабой концентрации. В альбуминах находится лейцин (до 15%) и очень мало глицина. В глобулинах больше глицина, находятся в более грубодисперсном состоянии, чем альбумины. Их можно разделить на α-, β-, γ-глобулины. Глобулины входят в состав ферментов, составляют основу иммуноглобулинов, выполняющих функции антител. Глобулины плазмы крови выполняют транспортную роль.
Растворимы в слабых растворах нейтральных солей; осаждаются сульфатом аммония при 50% насыщении. В воде нерастворимы, поэтому выпадают в осадок при очистке от солей диализом. Глобулины составляют большую часть белков семян многих растений, особенно бобовых и масляничных, например, легумин в семенах гороха, фазеолин – фасоли, эдестин – конопли. Отдельные фракции являются специфическими транспортерами веществ (транскотин – переносит глюкокортикоидные гормоны). Концентрация увеличивается при воспалении – белки острой фазы; участвуют в гуморальном иммунитете – иммуноглобулины.
Гистоны у человека в свободном состоянии не встречаются. В их составе преобладают остатки диаминомонокарбоновых кислот (аргинина 21-30%, лизина) и гистидина. Эти белки имеют резко основной характер. Представитель – глобин, который входит в состав гемоглобина. Гистоны встречаются в значительных количествах в белках эритроцитов и зобной железы поддерживают уникальную структуру ДНК.
Щелочные белки (12-30 кДа) содержат 20-30% щелочных аминокислот. Растворимы в слабых кислотах (0,2 нормальные растворы), осаждаются аммиаком, спиртом. Не содержат триптофана, а также цистеина и цистина. Входят в состав хроматина, поэтому имеются во всех ядросодержащих клетках. В процессе эволюции – консервативные белки.
Протамины – белки, включающие до 80% диаминомонокарбоновых кислот. Аргинина до 50%, у них ещё более ярко выражены основные свойства по сравнению с гистонами. Высоким содержанием протаминов отличаются сперма и икра рыб, а также многоядерные ткани. Протамины и гистоны составляют белковую часть нуклеопротеидов, поэтому представляют значительный биологический интерес.
Щелочные белки (12 кДа) содержат 80% щелочных аминокислот; отсутствуют или содержатся в малом количестве цис, три, асп, тир, фен. Являясь поливалентным органическим катионом, легко образуют комплексы с нуклеиновыми кислотами. Образуют хроматин, в связи с чем представлены во всех ядросодержащих клетках. В большом количестве встречаются в сперме рыб – сальмин у лососевых и клупеин у сельди.
Сложные (конъюгированные) белки.
Гликопротеины – содержат в своем составе гликозидные компоненты различной структуры. Гликопротеинами являются многие структурные белки, ферменты, рецептор и т.д. Большинство белков, расположенных на внешней поверхности животных клеток являются гликопротеинами. На долю углеводного компонента приходиться от 1-3 % (овальбумин) до 80-90 % (групповые вещества крови). В составе гликопротеинов обнаружено 10 различных моносахоридов: D – галактоза, D – манноза, D – глюкоза, N – ацетилглюкозамин, N – ацетилгалактозамин, дезоксисахара (L – фукоза, L – рамноза), D – ксилоза, L – арабиноза. Типичным компонентом гликопротеинов является нейраминовая кислота (чаще в форме сиаловых кислот).
Протеогликаны состоят из небольшой белковой части, к которой ковалентно присоединяется несколько десятков гетерополисахаридных цепей, содержащих в своих молекулах остатки аминосахаров и уроновых кислот. Углеводные компоненты – гликозамингликаны – представлены гиалуроновой кислотой, хондроитинсульфатами, гепарансульфатом, кератансульфатами.
В гликопротеидах крови содержатся глюкозамины. При усиленном расщеплении белков соединительной ткани, в частности, при злокачественном росте резко повышается содержание глюкозамина.
Липопротеины – В качестве небелковой части содержат молекулы липидов. Эти макромолекулы в значительных количествах находятся в митохондриях, из них в основном состоит эндоплазматический ретикулум, их обнаруживают в плазме крови и молоке. Инозитолдифосфатсодержащий липопротеин выделен из белого вещества мозга, в состав липопротеинов серого вещества мозга входят сфинголипиды. У растений значительная часть фосфолипидов в протоплазме находиться в форме липопротеинов.
Протеолипиды - комплексы липидов и белков, белковая часть которых содержит преимущественно гидрофобные аминокислоты.
Нуклеопротеины – Содержат нуклеиновые кислоты – РНК и ДНК – в качестве простетических групп.
Металлопротеины – Содержат ионы какого-либо одного или нескольких металлов. К таким белкам принадлежат белки, содержащие негеминовое железо (ферритин, трансферрин и др.). К медьсодержащим белкам относят цитохромоксидазу, пластоцианин ( переносчики электронов), белок крови – церулоплазмин; к железосодержащим – лактоферрин (белок молока), трансферрин (белок крови), ферритин и др. Кроме того известны: никелеплазмин (переносчик никеля в плазме крови), селенопротеины (кровь, мышцы), ванадохром ( у морских животных переносчик кислорода).
Фосфопротеины – В качестве простетической группы содержат фосфорную кислоту. К фосфопротеинам относят многие питательные белки, например, основной белок молока казеин, белки ячного желтка – вителлин и фосвитин, икры рыб – ихтулин. Они содержат 1-10% фосфора. Фосфопротеины найдены в мозге. Кратковременное фосфорилирование – дефосфорилирование ферментов является способом регуляции их активности.
Хромопротеины – В составе белка имеются окрашенные небелковые компоненты. Наиболее распространенными представителями хромопротеинов являются флавопротеины и гемопротеины, красное окрашивание которых обусловлено наличием гема с включенным в него атомом железа.
Размер молекул белка, растворимость, электрический заряд и другие физико-химические свойства их в большой мере определяют биологическую роль белков, их участие в процессах обмена веществ, а также в формировании структуры и функций организма.
Белки как коллоиды. Белки в организме находятся в коллоидном состоянии. При определенных условиях можно получить и кристаллические формы белков. Имея большой размер молекулы – 0,001-0,1 мкм, белки не проходят через полупроницаемые перегородки, какими являются клеточные мембраны. Этим пользуются для очистки растворов белка от остатков низкомолекулярных веществ (солей, сахаров) при изготовлении иммунных сывороток, сухой плазмы, γ-глобулина и других препаратов. Метод такой очистки белков получил название – диализ. Для растворов белков характерен оптический эффект Тиндаля (при пропускании пучка света через коллоидный раствор путь луча имеет вид светящегося конуса – см. рисунок 21, уч. Ермолаев. Биохимия, стр. 42) – это явление используется для определения белка методом нефелометрии. Явление диализа лежит в основе действия аппарата «искусственная почка», который широко используется в клиниках для лечения почечной недостаточности. Для коллоидных растворов характерна способность преломлять луч света, что используется для количественного определения белка методом рефрактометрии.
Молекулярная масса белков. Молекулярная масса белков колеблется от нескольких тысяч до миллионов. Размеры молекул отдельных белков могут приближаться к размерам наименьших живых существ.
Точность определения молекулярной массы белков зависит от метода и условий, в которых определяется эта масса, в частности, от реакции среды. Одной из характерных особенностей многих белков является их свойство образовывать молекулярные агрегаты, состоящие из нескольких молекул. При изменении температуры, величины рН, добавлении некоторых органических и минеральных веществ способность белков к агрегации или диссоциации на субъединицы изменяется. Это обусловливает изменение величины молекулярной массы белков и в определенной мере влияет на результаты изучения молекулярной массы.
Белки – амфотерные электролиты. Благодаря наличию в белках аминных и карбоксильных групп, они в кислой среде диссоциируют как основания, а в щелочной – как кислоты. Ионное состояние белков в большой мере обусловливает их физико-химические свойства. Так, вязкость, онкотическое давление, способность к набуханию зависят от степени диссоциации белков. Амфотерные свойства белков обусловливают их значение как буферных систем, поддерживающих постоянство реакции среды в тканях, их участие в регуляции рН крови.
Амфотерность белков используют для разделения их на фракции с целью диагностики ряда заболеваний и контроля за состоянием больного, так как при различных патологических состояниях фракционный состав белков существенно меняется.
Изоэлектрическое состояние белка. Свойства белков определяются свойствами аминокислот, из которых состоят белки. Аминокислоты – амфотерные соединения, и это их свойство обусловлено амино- и карбоксильными группами. Число таких групп зависит от числа основных и кислых аминокислот в белковой молекуле. Все эти группы в белке находятся в ионизированном состоянии в зависимости от рН. Белки также при определенном значении рН имеют нейтральный заряд, такое значение рН называют изоэлектрической точкой белка (рJ). При этом белок находится в наименее устойчивом состоянии. При рН ниже рJ увеличивается число положительных зарядов и молекула белка становится катионом. При рН выше рJ увеличивается число отрицательных зарядов и белок становится анионом. рJ большинства природных белков находятся в пределах рН 4,8-5,4, что свидетельствует о преобладании в их составе дикарбоновых кислот. Значение рJ белка важно для разделения белков методом электрофореза, который занимает а лабораторной практике важное место.
Все несущие заряд частицы передвигаются в электрическом поле в зависимости от величины заряда. Постоянное электрическое поле можно получить, используя источники постоянного напряжения и пропуская постоянный ток через буферный раствор. Выбирая рН буферного раствора, можно управлять характером распределения белков в электрическом поле. Скорость перемещения молекул зависит от ряда факторов: присутствия других ионов, температуры, молекулы носителя, на котором проводится разделение, величины заряда самой белковой молекулы. Метод разделения, учитывающий все указанные факторы, называется электрофорезом. Его применяют как для разделения белков, так и любых частиц, имеющих заряд.
Вначале разделение белков проводили в буферном растворе (электрофорез со свободной границей), а затем большое распространение получил электрофорез на носителях. Носителем служат полоски бумаги, ацетатцеллюлозы, агаровый, крахмальный, полиакриламидный гель, смоченные или содержащие буферный раствор. В клинической практике наибольшую популярность приобрел электрофорез на ацетатцеллюлозных полосках для разделения белков плазмы крови. Обычно белки плазмы в стандартных условиях электрофореза (буферный раствор рН 8,8) разделяются на 5 фракций. Полоски пропитывают красителем, который количественно связывается с белками, что позволяет после извлечения краски количественно оценить элекрофореграмму. Соотношение между отдельными фракциями меняется при разных заболеваниях. Для определения индивидуальных белков пользуются сочетанием электрофореза с иммунологическими реакциями (иммуноэлектрофорез).
Гидрофильность и гидрофобность белков. Белки обладают большим сродством к воде, т.е. вокруг белковой молекулы расположена гидратная оболочка, предохраняющая от склеивания и выпадения в осадок. Величина гидратной оболочки зависит от структуры белка. Альбумины связываются с молекулами воды и имеют большую водную оболочку, а глобулины, фибриноген присоединяет воду хуже и гидратная оболочка у них меньше.
Таким образом, устойчивость водного раствора белка определяется двумя факторами:
1) наличием электрического заряда белковой молекулы;
2) находящаяся вокруг молекулы водная оболочка.
При удалении этих факторов белок выпадает в осадок.
Адсорбция – способность поглощать на своей поверхности некоторые вещества и ионы (гормоны, витамины, железо, медь и др.), которые либо плохо растворимы в воде, либо являются токсичными (билирубин, свободные жирные кислоты). Белки транспортируют их по крови к местам дальнейших превращений или обезвреживания.
Осаждение белков.
а) обратимое – (высаливание) путем добавления солей щелочноземельных металлов. В основе действия лежит конкуренция их с белками за воду. Высаливающий эффект наступает при достаточно высоких концентрациях солей (насыщенные или полунасыщенные растворы). В практике часто используют Nа2SО4 и (NН4)2SО4. эти соли удаляют водную оболочку и снимают заряд. Глобулины, имеющие крупные и тяжелые молекулы и небольшую водную оболочку, выпадают в осадок при неполном насыщении раствора солями, а альбумины как более мелкие молекулы, окруженные большой водной оболочкой – при полном насыщении.
После удаления солей, белок возвращается в нативное состояние.
б) необратимое осаждение связано с нарушением пространственной структуры, что приводит к потере свойств. Это денатурация (в желудке, ожоги, свертывание крови и др.). денатурацию могут вызывать факторы: нагревание, облучение, механическое встряхивание, охлаждение, химическое воздействие – действие кислот и щелочей, ионов тяжелых металлов и др. Белки имеют высокую чувствительность к повышению температуры, поэтому термостабильность для белков не характерна. Денатурация – процесс разрушения пространственной структуры путем разрыва дисульфидных и слабых нековалентных связей. При этом происходит развертывание цепей и утрата биологической активности без разрушения пептидных связей, т.е. первичная структура белка сохраняется. Реакции осаждения белков используются в медицине для выделения и обнаружения белка в крови, моче. В лабораторной практике денатурация используется для депротеинизации биологических жидкостей.
Денатурация белков положена в основу лечения отравлений тяжелыми металлами, когда больному per os вводят молоко или сырые яйца с тем, чтобы Ме, денатурируя белки молока и яиц, адсорбировали их на поверхности Ме и не действовали на белки слизистой оболочки желудка и кишечника, а также не всасывались в кровь.
Конформация белков – это пространственное расположение в молекуле белка замещающих групп, способных свободно изменять своё положение в пространстве без разрыва каких-либо связей, благодаря свободному вращению вокруг одинарных углерод-углеродных связей.
В природе полипептидная цепь нативного белка имеет одну или очень ограниченное число конформаций. Эта нативная конформация является устойчивой и формирует её связи, делающие стабильной третичную структуру белка, которая называется нативной конформацией.
Основным свойством белка, обеспечивающим его функцию, является избирательное взаимодействие с определенным веществом – лигандом. Лигандами могут быть вещества разной природы, как низкомолекулярные, так и макромолекулы, в том числе белки. На белковых молекулах есть участки, центры связывания или активные центры, к которым присоединяется лиганд. Связи между белком и лигандом могут быть нековалентными и ковалентными. Высокая специфичность взаимодействия белка и лиганда обеспечивается комплементарностью структуры активного центра пространственной структуре лиганда.
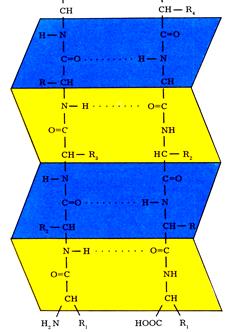
Белок-лигандное взаимодействие описывается уравнением:
   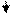 Р + L ↔ РL Р + L ↔ РL
белок лиганд белково-лигандный комплекс
Кдисс. – константа диссоциации комплекса
|
Из равновесия реакции следует, что если [Р] = [РL], то Кдисс.= [L]. Равенство [Р] и [РL] наступает при полунасыщении белка лигандом, т.е. 50% молекул белка связаны с лигандом, а 50% свободны. Максимальная величина РL означает, что весь белок связан с лигандом.
Четвертичная структура характерна для белков, состоящих из нескольких субъединиц и представляет собой взаиморасположение их в пространстве. Каждая из субъединиц несет часть функциональной активности. Например, молекула гемоглобина состоит из 4-х субъединиц, каждая из которых способна присоединять молекулу кислорода. При этом связывание кислорода одной субъединицей так изменяет конформацию остальных, что присоединение кислорода к ним облегчается, т.е. увеличивается их сродство к кислороду. Это так называемый кооперативный эффект.
Белки имеют сложную пространственную структуру. Исследователи выделили 4 уровня организации.
Первичная структура - понятие, обозначающее последовательность аминокислотных остатков в белке. Например,
  S S
Глу-Глун-Цис-Цис-Ала-Сер-Вал-Цис-Сер-Лей
(фрагмент одной из цепей молекулы инсулина) S S
Глу-Глун-Цис-Цис-Ала-Сер-Вал-Цис-Сер-Лей
(фрагмент одной из цепей молекулы инсулина)
|
Пептидная связь - основной вид связи, определяющий первичную структуру, она является ковалентной связью. Возможно и присутствие дисульфидных связей между двумя остатками цистеина в одной полипетидной цепи с образованием цистина.
Последовательность аминокислот в белке уникальна и детерминируется генами. Даже небольшие изменения первичной структуры могут серьезно изменять свойства белка. Первичная структура белков обеспечивает формирование последующих уровней структурной организации и определяет видовую специфичность белка.
Расшифрована первичная структура ряда ферментов: рибонуклеазы (129 аминокислот), карбоксипептидазы (309 аминокислот), некоторых гормонов. В последние годы внимание исследователей привлекают пептиды, состоящие из небольшого числа аминокислот и обладающие высокой биологической активностью. Гормон окситоцин (9 аминокислот) стимулирует сокращение гладкой мускулатуры (матки, молочной железы, кишечника). Гормон вазопрессин (9) - антидиуретический гормон, повышает кровяное давление, увеличивает реабсорбцию воды в почках. Недостаток его приводит к развитию несахарного диабета, при котором выделяется больше 10 л мочи в сутки, сильно разбавленной. Гормон инсулин контролирует содержание глюкозы в крови.
Определенный интерес представляет группа пептидов - энкефалины, которые вырабатываются в клетках ЦНС в ответ на болевые раздражения и ослабляют чувство боли. Так же обнаружены пептиды целенаправленного действия сна, жажды и т.д.
Вторичная структура - упорядоченная и компактная упаковка полипептидной цепи в пространстве. Она бывает в виде:
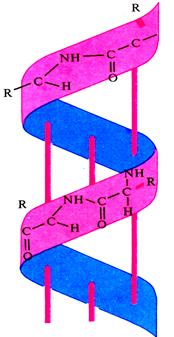
спирали складчатой структуры
Образование вторичной структуры обеспечивается водородной связью, нековалентной, α - спиральную конфигурацию поддерживают, в основном, водородные связи внутри полипептидной цепи, β-структура полипептидной цепи имеет зигзагообразную структуру, полипептидные цепи уложены параллельно друг другу в виде складчатого слоя. В β-конфигурации отсутствуют внутрицепочечные водородные связи, а имеются межцепочечные водородные связи между пептидными группами соседних полипептидных цепей. Вторичная структура способствует компактизации полипептидной цепи, укладывая ее в α-спираль или β-структуру, тем самым определяя такие свойства как прочность, нерастворимость.
Вторичная структура детерминирована размером, формой и полярностью боковых радикалов аминокислот полипептидных цепей. Вторичная структура характерна для альбуминов, глобулинов, кератина волос, коллагена сухожилий.
Третичная структура –расположена в пространстве всей полипептидной цепи, содержащей α-спирали, β-структуры. Большая часть белков на уровне этой структуры принимает глобулярную форму.

Основу составляют ионные связи, электростатические, в некоторых белках – ковалентные дисульфидные связи, которые стабилизируют третичную структуру. Третичная структура обеспечивает выполнение белком его основных функций. Глобулярные белки – альбумины и глобулины, обнаружены в крови и многих органах, фибриллярные – основа мышечных тканей. Характер третичной организации устанавливают с помощью рентгеноструктурного анализа.
Третичную структурупринято называть «нативной конформацией», т.е. нативные свойства белков (естественное состояние) определяются третичной структурой. При разрыве связей, стабилизирующих третичную структуру, белок теряет частично или в полной мере биологические и функциональные свойства.
Четвертичная структура –возникает в результате объединения нескольких субъединиц с третичной структурой в одну большую молекулу.
Связь между субъединицами нековалентная, хотя в ряде белков субъединицы соединены ковалентными дисульфидными мостиками. Четвертичная структура обеспечивает кооперативный эффект, например, молекула гемоглобулина состоит из 4 субъединиц (степень α-спирализации составляет 80%, т. е. наибольшую), каждая из которых способна присоединять молекулу кислорода. При этом связывание кислорода одной субъединицей изменяет конформацию других субъединиц таким образом, что присоединение кислорода к ним облегчается – это совместный (кооперативный) эффект.
Фермент ЛДГ– 4 субъединицы: 2Н и 2М. Их разные комбинации позволяют создать 5 ферментов, катализирующих одинаковую реакцию в разных органах и тканях: НННН, НННМ, ННММ, НМММ, ММММ. Такие белки называются – изопротеины или изоферменты. Изоферменты имеют различную локализацию в тканях. Это имеет важное значение для диагностики различных заболеваний.
Высшие уровни структуры молекулы белка обусловлены в основном особенностями первичной структуры, но в значительной мере зависят также и от условий среды, в которой находится белок (рН, t°).
Лекция № 3.
Дата добавления: 2018-03-01; просмотров: 2214;