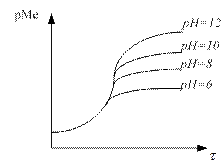
Кривые комплексонометрического титрования
Кривые комплексонометрического титрования изображают изменение рМе (рМе = -lg[Men+]) по мере приливания стандартного раствора комплексона.
На форму кривой сильно влияет рН раствора. При рН<6 кривая титрования не имеет скачка. При одном и том же значении рН раствора, скачок титрования тем больше, чем больше устойчивость комплекса Ме-комплексон.
 |
Пример. Рассмотрим расчет кривой титрования 50,00 см3 раствора Са2+ с молярной концентрацией эквивалента 0,0100 моль/дм3 раствором трилона Б с молярной концентрацией эквивалента 0,0100 моль/дм3 при рН = 12.
Расчет ведем с учетом разбавления раствора:
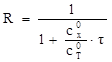
Так как cХ0 = cТ0, то 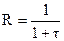 .
.
Рассчитаем изменение концентрации ионов Са2+ и рСа в различные моменты титрования.
1) До начала титрования τ = 0:
рСа = - lg [Са2+] = - lg0,01 = 2
2) До Т.Э. при 0 < τ < 1:
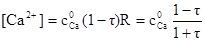
рСа раствора рассчитываем при следующих значениях τ:
а) τ = 0,1
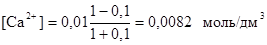 рСа = - lg [Са2+] = 2,09
рСа = - lg [Са2+] = 2,09
б) τ = 0,5
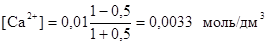 рСа = - lg [Са2+] = 2,48
рСа = - lg [Са2+] = 2,48
в) τ = 0,9
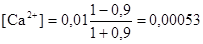 моль/дм3 рСа = - lg [Са2+] = 3,28
моль/дм3 рСа = - lg [Са2+] = 3,28
г) τ = 0,99
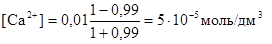 рСа = - lg [Са2+] = 4,30
рСа = - lg [Са2+] = 4,30
д) τ = 0,999
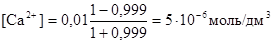 рСа = - lg [Са2+] = 5,30
рСа = - lg [Са2+] = 5,30
3) В Т.Э. τ = 1
Ионы металла появляются вследствие распада комплекса. Концентрацию ионов металла выражаем из уравнения константы устойчивости комплекса
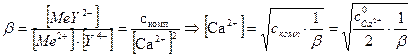 | |||
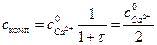 | |||
где β – константа устойчивости комплекса СаY2-,
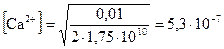 ; рСа = 6,28.
; рСа = 6,28.
4) После Т.Э. τ > 1. Концентрация трилона Б равна:
[Т] = [Н2Y2-] = CТ0 (τ - 1) R,
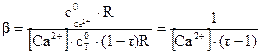
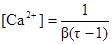
а) τ = 1,001
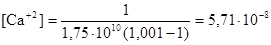 моль/дм3 рСа = 7,24
моль/дм3 рСа = 7,24
б) τ = 1,01 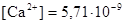 моль/дм3 рСа = 8,24
моль/дм3 рСа = 8,24
в) τ = 1,1 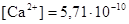 моль/дм3 рСа = 9,24
моль/дм3 рСа = 9,24
г) τ = 1,5 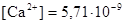 моль/дм3 рСа = 9,94
моль/дм3 рСа = 9,94
Расчетные данные для построения кривой титрования
| № п/п | τ | Состав раствора | Расчетная формула | pCa |
| [Са2+] | 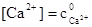
| 2,00 | ||
| 0,10 | [Са2+] | 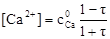
| 2,09 | |
| 0,50 | [Са2+] | 2,48 | ||
| 0,90 | [Са2+] | 3,28 | ||
| 0,99 | [Са2+] | 4,30 | ||
| 0,999 | [Са2+] | 5,30 | ||
| [Са2+]= [Y4-] | 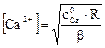
| 6,28 | ||
| 1,001 | [Y4-] | 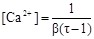
| 7,24 | |
| 1,01 | [Y4-] | 8,24 | ||
| 1,10 | [Y4-] | 9,24 | ||
| 1,50 | [Y4-] | 9,94 |
По данным таблицы строим кривую титрования:
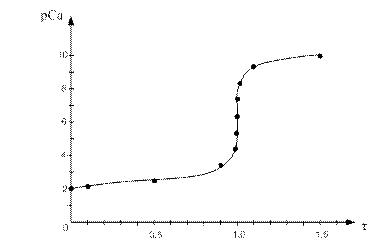
Для ошибки титрования ± 0,1 % скачок титрования
∆рСa = рCaτ=1,001 - рCaτ=0,999 = 7,24 - 5,30 = 1,94.
Для ошибки титрования ± 1,0 % скачок титрования
∆рCa = рCaτ=1,01 - рCaτ=0,99 = 8,24 - 4,30 = 3,94.
При титровании раствора Ca2+ раствором комплексона III в качестве индикатора может быть использован мурексид (пурпурат аммония), который окрасит титруемый раствор в красный цвет, благодаря образованию с катионами кальция окрашенного комплексного соединения. В Т.Э. окраска раствора изменится из красной в сине-фиолетовую, свойтсвенную для свободного мурексида, т.к. в процессе титрования комплексное соединение с индикатором разлагается комплексоном III с образованием более устойчивой внутрикомплексной соли.
Ошибки титрования
Вследствие несовпадения точки конца титрования и Т.Э. возникает индикаторная ошибка титрования
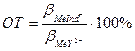 где
где 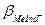 и
и 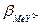 - константы устойчивости комплексов Ме-индикатор и
- константы устойчивости комплексов Ме-индикатор и
Ме-комплексон.
Дата добавления: 2017-11-04; просмотров: 3078;
