Стереохимия механизма SN1.
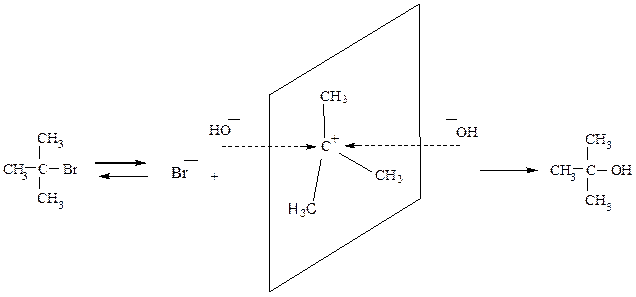
Промежуточно образующийся карбкатион имеет плоское строение, поэтому подход нуклеофила и его присоединение равновероятно с обеих сторон. Если возможно образование двух пространственных изомеров, то они образуются в примерно равных количествах
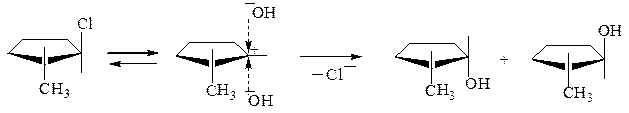 транс-2-хлор-1- цис-2-метилцикло- транс-2-метил-метилциклопентан пентанол-1 циклопентанол-1
транс-2-хлор-1- цис-2-метилцикло- транс-2-метил-метилциклопентан пентанол-1 циклопентанол-1
Мономолекулярные реакции часто осложняются побочными процессами, связанными со склонностью карбокатионов к перегрппировкам.
Так, гидролиз 1-хлор-2-метилпропана в результате 1,2-гидридного сдвига приводит не к 2-метилпропанолу-1, а к трет-бутанолу.
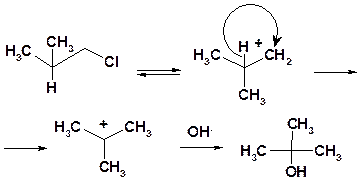
Стереохимия механизма SN2. В переходном состоянии центральный атом углерода и три заместителя лежат в одной плоскости. Естественно, нуклеофильная частица подходит со стороны, противоположной атому галогена. В случае, если возможно образование пространственных изомеров, то образуется лишь один из них.
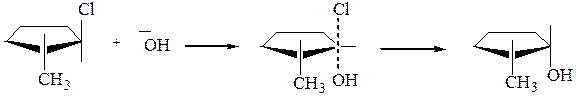
транс-2-хлор-1- переходное цис-2-метилцикло-
метилциклопентан состояние пентанол-1
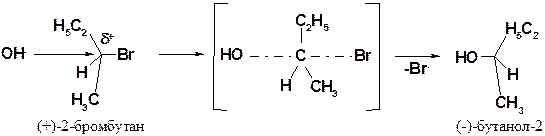
Происходит полное обращение конфигурации.
В некоторых примерах реакций SN возможны два направления протекания процесса, приводящие к образованию различных веществ. Это происходит благодаря способности некоторых нуклеофилов проявлять амбидентные свойства, т.е. обладать в зависимости от условий реакции двойственной реакционной способностью. Так, результат нуклеофильной атаки нитрит-анионом 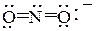 на молекулу алкилгалогенида в зависимости от механизма замещения будет различным: при SN1 нитрит-анион атакует местом наибольшей отрицательности, т.е. кислородным атомом, образуя 2-гексилнитрит (эфир азотистой кислоты R–O–N=O); при SN2 – местом наибольшей нуклеофильности, т.е. атомом азота, в результате чего образуется нитросоединение R–NO2. Образование смеси продуктов свидетельствует о том, что оба механизма имели место. Для того, чтобы повысить степень протекания SN1 – реакции (приводящей к 2-гексилнитриту) следует использовать еще более полярный, чем этанол, растворитель или заменить нитрит натрия на нитрит серебра, поскольку ионы Ag+ способствуют гетеролизу связи углерод – галоген, т.к. образуется практически недиссоциированный AgBr. Чтобы повысить выход 2-нитрогексана продукта реакции SN2 – реакции, надо использовать ДМФА, являющийся апротонным биполярным растворителем, не способным сольватировать анионы за счет образования водородных связей с ними, но сольватирующий катионы Na+ . Вследствие этого анионы обладают большей степенью свободы и являются более сильными нуклеофилами.
на молекулу алкилгалогенида в зависимости от механизма замещения будет различным: при SN1 нитрит-анион атакует местом наибольшей отрицательности, т.е. кислородным атомом, образуя 2-гексилнитрит (эфир азотистой кислоты R–O–N=O); при SN2 – местом наибольшей нуклеофильности, т.е. атомом азота, в результате чего образуется нитросоединение R–NO2. Образование смеси продуктов свидетельствует о том, что оба механизма имели место. Для того, чтобы повысить степень протекания SN1 – реакции (приводящей к 2-гексилнитриту) следует использовать еще более полярный, чем этанол, растворитель или заменить нитрит натрия на нитрит серебра, поскольку ионы Ag+ способствуют гетеролизу связи углерод – галоген, т.к. образуется практически недиссоциированный AgBr. Чтобы повысить выход 2-нитрогексана продукта реакции SN2 – реакции, надо использовать ДМФА, являющийся апротонным биполярным растворителем, не способным сольватировать анионы за счет образования водородных связей с ними, но сольватирующий катионы Na+ . Вследствие этого анионы обладают большей степенью свободы и являются более сильными нуклеофилами.
Подобно нитрит-аниону NO2- двойственной реакционной способностью, обладает также цианид-анион имея два нуклеофильных центра, различающихся по основности:  . Направление реакции зависит от механизма реакции. В водно-этанольной среде (а) образуется смесь нитрила (основной продукт) и изонитрила (побочный продукт); применение AgCN сдвигает реакцию в область SN1 – образуется изонитрил (б); в ДМФА протекает SN2 с образованием нитрила (в).
. Направление реакции зависит от механизма реакции. В водно-этанольной среде (а) образуется смесь нитрила (основной продукт) и изонитрила (побочный продукт); применение AgCN сдвигает реакцию в область SN1 – образуется изонитрил (б); в ДМФА протекает SN2 с образованием нитрила (в).
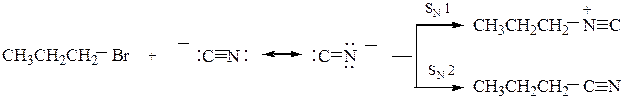
Материал, изложенный выше, относился к замещению галогена у насыщенного углеродного атома. Атомы галогена, находящиеся у ненасыщенного атома углерода (в состоянии sp2 или sp-гибридизации), значительно менее подвижны. Связь С–Hal короче и прочнее связи в насыщенных галогенопроизводных, благодаря эффекту сопряжения. К группе галогенопроизводных с пониженной реакционной способностью принадлежат арилгалогениды, в которых атом галогена связан непосредственно с углеродом ароматического цикла. Галогены обладают положительным мезомерным эффектом (+М), находятся в сопряжении с ароматическим кольцом и электронная плотность частично втянута в цикл. Связь углерод-галоген частично двойная, значительно прочнее связи углерод (sp3)-галоген.
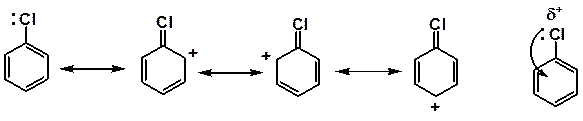 В реакциях ароматического электрофильного замещения галогены являются дезактивирующими заместителями и орто-пара-ориентантами.
В реакциях ароматического электрофильного замещения галогены являются дезактивирующими заместителями и орто-пара-ориентантами.
Напротив, реакционная способность атома галогена в аллильном положении очень высока. Замещение его всегда идет по механизму SN1.
¯OH
СH2=CH–CH2–Cl ¾® Cl- + СH2=CH–C+H2 ¾® СH2=CH–CH2–OH
В карбкатионе положительный заряд компенсируется наполовину сдвигом
½ + ½ +
π-электронов соседней двойной связи CH2 ¼ CH ¼ CH2 поэтому равно-вероятно присоединение и к 1- и к 3-атомам углерода. В более сложных соединениях может образоваться смесь изомерных продуктов замещения.
CH3
СH3–СH=CH–CH2–Cl +NaCN ¾®СH3–СH=CH–CH2–CN + СH2=СH–CH–CN
-NaCl нитрил 3-пентеновой нитрил 2-метил-3-
кислоты -бутеновой кислоты
Вследствие сопряжения неподеленной пары электронов с единым π-электронным облаком атом галогена в бензольном ядре наиболее инертен. Замещение в мягких условиях может проходить лишь при наличии в ядре активирующих заместителей.
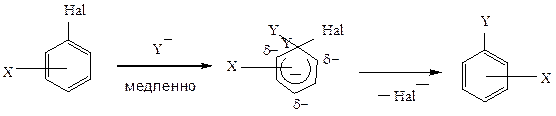
Здесь реализуется механизм нуклеофильного замещения второго порядка, но переходное состояние внешне напоминает σ-комплекс в электрофильном замещении. Такой механизм принято называть SN2 (аром.). Сильные акцепторы поляризуют бензольное кольцо, наводя положительный заряд в о- и п-положениях. Фтор в меньшей степени, чем другие галогены способен компенсировать δ+ за счет +С-эффекта, поэтому влияние на его подвижность заместителей-акцепторов наиболее сильно
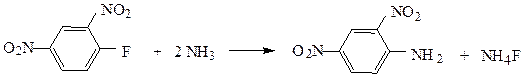
Поскольку галогеноарены – соединения с низкой реакционной способностью – реакции нуклеофильного замещения, характерные для насыщенных галогенопроизводных, в этом ряду не имеют такого большого значения.
В отсутствие электронодонорных заместителей атомы галогенов в бензольном ядре замещаются на гидроксил только в весьма жестких условиях.
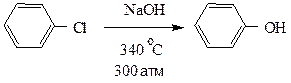
пара-Нитрохлорбензол вступает в аналогичную реакцию уже при 160о.
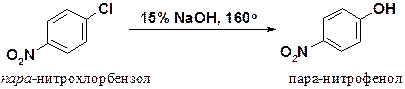
Еще легче протекает замещение галогена в ди- и тринитрохлорбензолах.
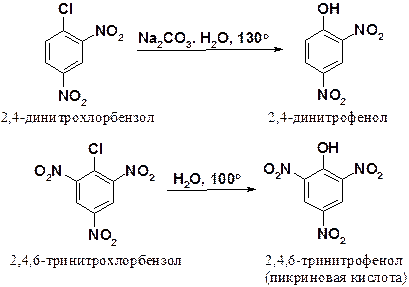
Также в жестких условиях, в присутствии катализатора Ульмана (мелкораздробленная медь) протекают и другие реакции замещения галогена.
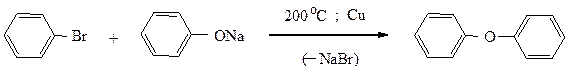
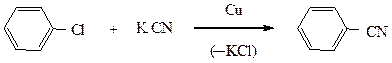
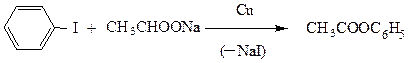
Замещение атома хлора и брома на аминогруппу происходит под действием амида натрия в жидком аммиаке.
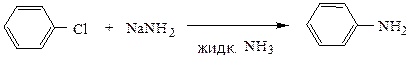
В боковой цепи ароматических галогенопроизводных атом галогена, удаленный от ядра, обладает нормальной подвижностью галогена в предельных соединениях. В α-положении к ядру галоген особенно подвижен. Замещение его всегда идет по механизму SN1.
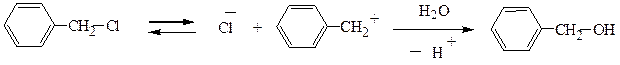
При диссоциации образуется один из самых стабильных карбкатионов, где заряд компенсируется сдвигом π-электронного облака.
Итак, можно написать два ряда сравнительно подвижности атома галогена в молекулах галогенопроизводного (реакционная способность в приведенных рядах падает слева направо):
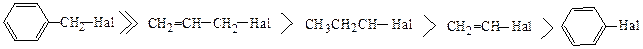
II. Реакции элиминирования (отщепления)
С реакциями замещения галогена конкурируют реакции отщепления, которые преобладают при действии сильных оснований (спиртовой раствор щелочи, третичные ароматические амины и др.)
Отщепление галогеноводородов обычно протекает так, что атомы водорода и галогена отщепляется от соседних углеродных атомов (правило Зайцева). Такой процесс называется β-элиминированием.
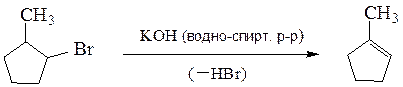
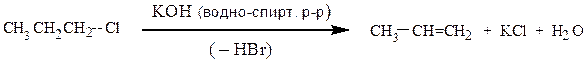
β-Элиминирование обычно протекает по одному из механизмов: E1 или Е2.
Механизм Е1. Скорость реакции зависит только от концентрации галогенопроизводного v = k • [RHa1]. Медленная стадия, определяющая скорость реакции
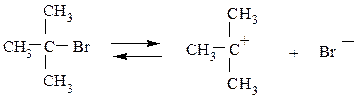
Эта стадия совпадает с первой стадией реакции замещения SN1. Вторая (быстрая) стадия реакции отщепления заключается в отрыве протона
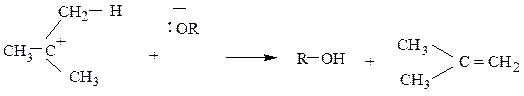
Реакция может протекать и в нейтральной, и в кислой среде. Тогда вторая стадия выглядит так:
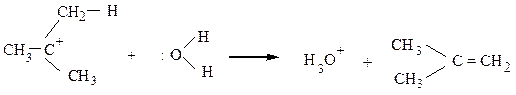
Как правило, реакции SN1 и Е1 протекают одновременно, и образуется смесь продуктов замещения и отщепления.
Механизм Е2. Скорость реакции пропорциональна концентрации галогена и основания. Например, v = k • [RHa1] • [ -ОR ]. Атакующее основание отрывает протон от β-углеродного атома, одновременно с образованием двойной связи и уходом иона галогена

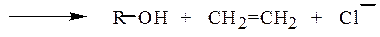
При этом конкурирующей реакцией также является замещение галогена. Элиминирование протекает тем легче, чем сильнее используемое основание
Повышение температуры также способствует преобладанию реакции отщепления над замещением.
Скорость элиминирования производных различных галогенов соответствует связи энергии C–Hal и возрастает в ряду: R–F → R–Сl → R–Br → RI.
В большинстве случаев в результате реакции элиминирования возможно образование двух или даже трех различных алкенов в зависимости от того, какой из β-водородных атомов отщепляется на стадии, определяющей скорость
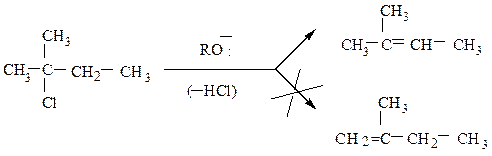
Направленность реакции подчиняется правилу Зайцева: отщепление галогеноводородов от галогенопроизводного происходит таким образом, что с атомом галогена преимущественно отщепляется водород от соседнего наименее гидрогенизированного атома углерода. Образующийся наиболее полно замещенный этилен термодинамически более стабилен. При механизме Е2 главную роль в такой направленности играет стабильность переходного состояния
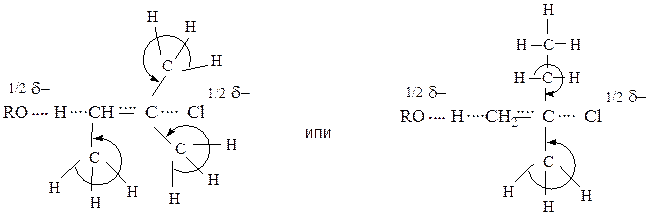
Первое переходное состояние стабилизировано эффектом сверхсопряжения трех метильных групп.
В отличие от SN2 в случае Е2 отсутствуют стерические препятствия отщеплению галогена от третичного углеродного атома. Поэтому в большинстве случаев элиминирование протекает именно по Е2. Однако для осуществления этого механизма необходимо, чтобы атомы галогена, отщепляющегося водорода, а также α- и β-углеродные атомы могли расположиться в одной плоскости, причем отщепляющиеся атомы должны в переходном состоянии находиться в транс-положении друг к другу
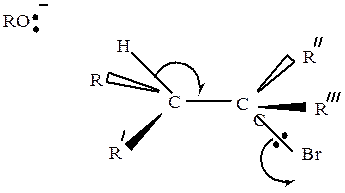
Освобождающаяся пара электронов связи Сβ–Н атакует «с тыла» атом Сα, вытесняя пару электронов связи Сα–Н на атом хлора.
В случае производных циклогексана отщепляющиеся атомы должны находиться в транс-диаксиальном положении
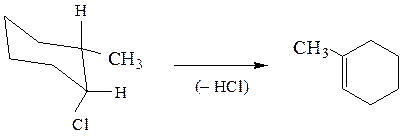
При невозможности принятия такой конформации протекает элиминирование против правила Зайцева
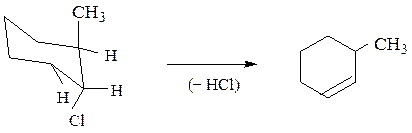
Дигалогенопроизводные, содержащие атомы галогена при одном и том же (геминальные) или при соседних (вицинальные) атомах углерода, подвергаясь дегидрогалогенированию образуют алкины или диены.
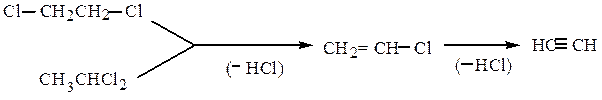
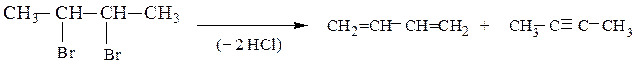
Реакции дегалогенирования. Дегалогенирование (отщепление двух атомов галогена) происходит при действии на дигалогенопроизводное цинка (или магния) в ацетоне или уксусной кислоте. Вицинальные соединения при этом образуют алкены
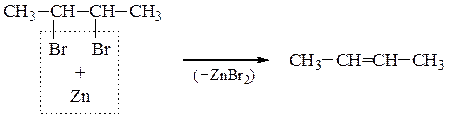
Реакция протекает по механизму Е2 и подчиняется всем его закономерностям.
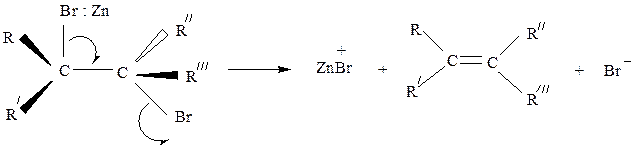
При действии цинка на 1,3- ; 1,4- и 1,5-дигалогенпроизводные происходит образование циклических соединений. Реакция служит удобным способом получения малых циклов.
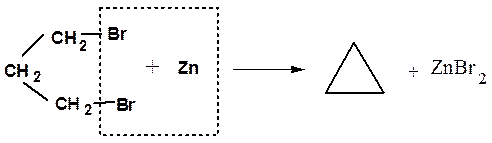
α-Элиминирование – отщепление двух заместителей от одного атома углерода. В классе галогенопроизводных реакция распространена для производных метана. При действии сильных оснований от молекулы хлороформа может отщепляться хлороводород
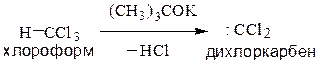
Дихлоркарбен представляет собой бирадикал, имеющий два неспаренных электрона при одном атоме углерода. Он крайне реакционноспособен. Легко присоединяется по двойной связи, образуя производные циклопропана
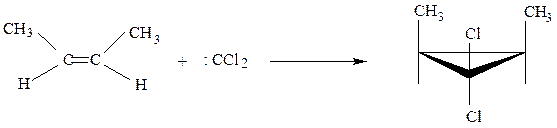
цис-бутен-2 цис-3,3-дихлор-1,2-диметилциклопропан
По-видимому образование обеих связей происходит одновременно, ибо образуется стереоспецифичный продукт
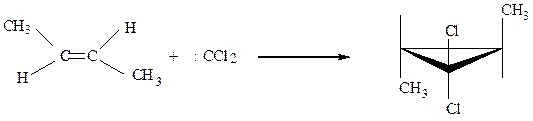
транс-бутен-2 транс-3,3-дихлор-1,2-диметил циклопропан
Незамещенный карбен образуется при α-элиминировании йодистого метилена действием цинка, имеющего омедненную поверхность (цинк-медная пара)
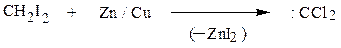
Присоединение карбена к двойной связи (реакция Симмонса-Смта) рассматривалась при изучении свойств алкенов
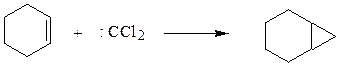
циклогексен бицикло(4,1,0)гептан
Дата добавления: 2017-09-19; просмотров: 3533;
