Электроды сравнения
Для определения электродного потенциала элемента необходимо измерить ЭДС гальванического элемента, составленного из испытуемого электрода и электрода с точно известным потенциалом – электрода сравнения. В качестве примеров рассмотрим водородный, каломельный и хлорсеребряный электроды.
Водородный электрод представляет собой платиновую пластинку, омываемую газообразным водородом, погруженную в раствор, содержащий ионы водорода. Адсорбируемый платиной водород находится в равновесии с газообразным водородом; схематически электрод изображают следующим образом:
Рt, Н2 / Н+
Электрохимическое равновесие на электроде можно рассматривать в следующем виде:
2Н+ + 2е- ––> Н2
Потенциал водородного электрода зависит от активности ионов Н+ в растворе и давления водорода; потенциал стандартного водородного электрода (с активностью ионов Н+ 1 моль/л и давлением водорода 101.3 кПа) принят равным нулю. Поэтому для электродного потенциала нестандартного водородного электрода можно записать:
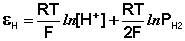 (III.49)
(III.49)
Каломельный электрод. Работа с водородным электродом довольно неудобна, поэтому в качестве электрода сравнения часто используется более простой в обращении каломельный электрод, величина электродного потенциала которого относительно стандартного водородного электрода точно известна и зависит только от температуры. Каломельный электрод состоит из ртутного электрода, помещенного в раствор КСl определенной концентрации и насыщенный каломелью Hg2Сl2:
Нg / Нg2Сl2, КСl
Каломельный электрод обратим относительно анионов хлора и уравнение Нернста для него имеет вид:
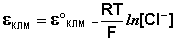 (III.50)
(III.50)
Хлорсеребряный электрод. В качестве электрода сравнения используют также другой электрод второго рода – хлорсеребряный, который также обратим относительно анионов хлора:
Аg / АgСl, КСl
Величина потенциала хлорсеребряного электрода зависит от активности ионов хлора; данная зависимость имеет следующий вид:
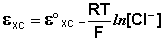 (III.51)
(III.51)
Чаще всего в качестве электрода сравнения используется насыщенный хлорсеребряный электрод, потенциал которого зависит только от температуры.
Дата добавления: 2017-09-19; просмотров: 796;
