Смещение равновесия
В соответствии с принципом Ле Шателье, если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то равновесие сместится в сторону протекания той реакции, которая ослабляет это воздействие.
На примере
3H2 + N2 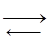 2NH3 – DH.
2NH3 – DH.
1. Влияние концентрации. Если увеличить концентрацию исходных веществ, то равновесие сместится в сторону образования продуктов и, наоборот.
Если уменьшить концентрации исходных веществ N2 и Н2, это приведет к смещению равновесия справа налево, в результате концентрации N2 и Н2 вновь увеличатся за счет разложения аммиака.
2. Влияние давления. При этом учитываются только газообразные участники реакции. При увеличении давления равновесие смещается в сторону системы, состоящей из меньшего числа моль газообразных веществ.
Увеличение давления системы приведет к смещению равновесия слева направо, т.к. в левой части общее число моль газов 4, а в правой 2.
3. Влияние температуры. Зависит от теплового эффекта реакции.
Химические уравнения, в которых указан тепловой эффект реакций называются термохимическими уравнениями. В термохимических уравнениях химических реакций тепловой эффект указывают при помощи величины DH, которая называется изменением энтальпии (теплосодержания) реакции. Энтальпия является мерой энергии, накапливаемой веществом при его образовании.
–DH, теплота выделяется, т.е. реакция – экзотермическая;
+DH, теплота поглощается, т.е. реакция – эндотермическая;
Прямая реакция экзотермическая, т.е. при повышении температуры равновесие будет смещаться справа налево, в сторону эндотермической реакции.
4. Влияние катализатора. Катализаторы одинаково ускоряют как прямую, так и обратную реакцию, и поэтому не смещают химическое равновесие, а только способствуют более быстрому достижению равновесного состояния.
Задание. Газовая системе А + В 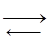 С – DH. Какое влияние на равновесную концентрацию вещества С окажет:
С – DH. Какое влияние на равновесную концентрацию вещества С окажет:
а) увеличение давления. В левой части 2 моль веществ. В правой 1 моль, т.е. равновесие смещается слева направо в сторону образования вещества С, концентрация С увеличивается.(®)
б) увеличение концентрации вещества А. Равновесие смещается слева направо в сторону образования вещества С, концентрация С увеличивается.(®).
в) повышение температуры. Прямая экзо, обратная – эндотермическая. Равновесие сместится справа налево ().
Задание. Как повлияет на равновесие системы увеличение давления?
Fe3O4(тв) + СО(г) 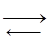 3FeO + CO2(г)
3FeO + CO2(г)
Равновесие в системе не сместится.
Задание. Каким образом надо изменить температуру, давление и концентрацию, чтобы сместить равновесие в сторону прямой реакции?
PCl5(г) 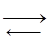 PCl3(г) + Cl2(г) + 92,59 кДж
PCl3(г) + Cl2(г) + 92,59 кДж
а) реакция эндотермическая, температуру надо повысить.
б) давление надо уменьшить
в) либо увеличить концентрацию PCl5, либо уменьшить концентрации PCl3 и Cl2.
Задание.2SO2(г)+О2(г) Û 2SO3(ж). Какое влияние на равновесное состояние окажут:
а) увеличение давления;
При протекании прямой реакции количество газообразных веществ в системе уменьшается (из 2 моль газа SO2 и 1 моль газа О2 образуется жидкость SO3). Повышение давления приведет к смещению равновесия в сторону образования меньшего количества газообразных веществ, т. е. SO3. (®).
б) уменьшение концентрации оксида серы (VI)?
Уменьшение концентрации SO3 (отвод продукта из реакционной системы) вызовет смещение равновесия в сторону образования SO3. (®).
Задание.А + В Û 2С – 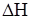
Какое влияние окажут на равновесное состояние:
а) понижение температуры;
Из приведенного термохимического уравнения реакции следует, что прямая реакция является экзотермической (так как 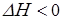 ), следовательно, обратная реакция – эндотермическая, понижение температуры будет способствовать протеканию реакции, которая увеличивает температуру системы, т. е. экзотермической реакции. Поэтому при понижении температуры равновесие сместится в сторону образования вещества С.
), следовательно, обратная реакция – эндотермическая, понижение температуры будет способствовать протеканию реакции, которая увеличивает температуру системы, т. е. экзотермической реакции. Поэтому при понижении температуры равновесие сместится в сторону образования вещества С.
б) катализатор?
Катализатор не приводит к смещению равновесия в системе, так как в одинаковой степени ускоряет прямую и обратную реакции.
Дата добавления: 2017-09-19; просмотров: 1091;
