Таблицы исходных данных
Таблица 3. Исходные данные к заданию 3.
| № вар. | Электролит | 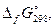 кДж/моль
кДж/моль
| № вар. | Электролит | 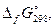 кДж/моль
кДж/моль
|
| AgBr | Hg2Cl2 | ||||
| AgI | Hg2Br2 | ||||
| AgIO3 | -92 | Hg2I2 | -111 | ||
| AgCN | Hg2SO4 | ||||
| Ag2SO4 | Ni(OH)2 | -459 | |||
| Ag2CrO4 | -635 | PbBr2 | 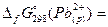 =-24 кДж/моль =-24 кДж/моль
| ||
| Ag2S | PbI2 | ||||
| Ca(OH)2 | PbSO4 | ||||
| CdCO3 | -674 | PbS | |||
| Cd(OH)2 | -474 | TlCl | |||
| Co(OH)2 | -456 | TlI | -125 | ||
| CuCl | Zn(OH)2 | ||||
| CuI | -70 | ZnS | |||
| Fe(OH)2 | -493 | Ca(OH)2 |
Примечание. В табл. 3 приведены стандартные энергии Гиббса образования веществ, отсутствующие в ²Кратком справочнике…².
Таблица 4. Исходные данные к заданию 4.
| № ваp. | A | B | M1 | C | D | M2 | а(A) | a(B) | a(C) | a(D) |
| Cu2+ | — | Cu | Br2(ж) | Br– | Pt | 0,02 | — | 0,03 | ||
| Cu2+ | — | Cu | O2 | OH– | Pt | 0,03 | — | 1,5 | 0,02 | |
| Cr3+ | — | Cr | Cl2 | Cl– | Pt | 0,05 | — | 1,2 | 0,02 | |
| Fe3+ | Fe2+ | Pt | Cr3+ | Cr2+ | Pt | 0,005 | 0,15 | 0,1 | 0,001 | |
| Fe(CN)63– | Fe(CN)64– | Pt | Co3+ | Co2+ | Pt | 0,06 | 0,06 | 0,04 | 0,005 | |
| Ag+ | — | Ag | Ag2O | OH– | Ag | 0,04 | — | 0,03 | ||
| Co3+ | Co2+ | Pt | Fe(CN)63– | Fe(CN)64– | Pt | 0,04 | 0,009 | 0,06 | 0,001 | |
| H+ | H2 | Pt | O2 | OH– | Pt | 0,04 | 1,5 | 0,5 | 0,06 | |
| H+ | H2 | Pt | Cl2 | Cl– | Pt | 0,05 | 0,6 | 0,5 | 0,02 | |
| Cl2 | Cl– | Pt | AgCl | Cl– | Ag | 1,5 | 0,04 | 0,04 | ||
| AgI | I– | Ag | AgCl | Cl– | Ag | 0,02 | 0,06 | |||
| Cu2+ | Cu+ | Pt | Sn4+ | Sn2+ | Pt | 0,14 | 0,009 | 0,002 | 0,08 | |
| H3AsO4 | HAsO2 | Pt | MnO4– | MnO42– | Pt | 0,08 | 0,04 | 0,02 | 0,007 | |
| V3+ | V2+ | Pt | Tl3+ | Tl+ | Pt | 0,016 | 0,007 | 0,001 | 0,1 | |
| Hg22+ | Hg | Pt | Cl2 | Cl– | Pt | 0,04 | 0,8 | 0,06 | ||
| H3AsO4 | HAsO2 | Pt | V3+ | V2+ | Pt | 0,15 | 0,005 | 0,005 | 0,01 | |
| O2 | OH– | Pt | AgI | I– | Ag | 1,5 | 0,05 | 0,04 | ||
| H2 | OH– | Pt | O2 | OH– | Pt | 2,0 | 0,02 | 0,8 | 0,02 | |
| Ag+ | — | Ag | S2O62– | SO42– | Pt | 0,02 | — | 0,07 | 0,03 | |
| Ag2SO4 | SO42– | Ag | V3+ | V2+ | Pt | 0,02 | 0,01 | 0,02 | ||
| PbBr2 | Br– | Pb | S2O62– | SO42– | Pt | 0,005 | 0,005 | 0,03 | ||
| MnO4– | MnO42– | Pt | Mn2+ | MnO4– | Pt | 0,009 | 0,014 | 0,07 | 0,009 | |
| Mn2+ | MnO4– | Pt | Sn4+ | Sn2+ | Pt | 0,01 | 0,02 | 0,08 | 0,15 | |
| Fe3+ | Fe2+ | Pt | I3– | I– | Pt | 0,02 | 0,03 | 0,01 | 0,04 | |
| Ni2+ | — | Ni | I3– | I– | Pt | 0,01 | — | 0,03 | 0,06 | |
| Hg22+ | Hg | Pt | AgBr | Br– | Ag | 0,08 | 0,01 | |||
| MnO4– | MnO42– | Pt | Fe3+ | Fe2+ | Pt | 0,018 | 0,005 | 0,15 | 0,05 | |
| PbSO4 | SO42– | Pb | Br2(ж) | Br– | Pt | 0,05 | 0,05 |
Примечание. В таблице 4 введены следующие обозначения: М1 и М2 – металлические электроды; A, B, C, D – ионы или молекулы, присутствующие в приэлектродном электролите; a(A), a(B), a(C), a(D)– соответствующие активности. Активность воды принимается равной единице. В вариантах, номера которых обведены рамкой №, активность протонов a(H+) принять равной 0,2.
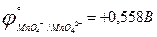
Таблица 5. Исходные данные к заданию 5.
| № вар. | Уравнение реакции | 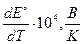
|
Zn + 2AgCl  ZnCl2 + 2Ag ZnCl2 + 2Ag
| -7,57 | |
Zn + Hg2SO4  ZnSO4 + 2Hg ZnSO4 + 2Hg
| -9,48 | |
Cd + Hg2SO4  CdSO4 + 2Hg CdSO4 + 2Hg
| -7,95 | |
Cd + 2AgCl  CdCl2 + 2Ag CdCl2 + 2Ag
| -6,04 | |
Cd + PbCl2  CdCl2 + Pb CdCl2 + Pb
| -4,16 | |
Zn + Hg2Cl2  ZnCl2 + 2Hg ZnCl2 + 2Hg
| -4,13 | |
Pb + 2AgI  PbI2 + 2Ag PbI2 + 2Ag
| -1,83 | |
2Hg + 2AgCl  Hg2Cl2 + 2Ag Hg2Cl2 + 2Ag
| -3,44 | |
Pb + Hg2Cl2  PbCl2 + 2Hg PbCl2 + 2Hg
| 1,57 | |
Mg + 2HCl  MgCl2 + H2 MgCl2 + H2
| -1,13 | |
2Cu + I2  2CuI 2CuI
| 0,60 | |
2FeCl3 + H2  2FeCl2 + 2HCl 2FeCl2 + 2HCl
| 11,88 | |
Fe + NiCl2  FeCl2 + Ni FeCl2 + Ni
| 0,80 | |
2Al + Cr2(SO4)3  Al2(SO4)3 + 2Cr Al2(SO4)3 + 2Cr
| -3,13 | |
Pb + Ag2S  PbS + 2Ag PbS + 2Ag
| -1,66 | |
Pb + I2  PbI2 PbI2
| -0,29 | |
2Cr + 3SnCl2  2CrCl3 + 3Sn 2CrCl3 + 3Sn
| -4,28 | |
Cu + 2AgNO3  Cu(NO3)2 + 2Ag Cu(NO3)2 + 2Ag
| -9,72 | |
3Zn + 2CrCl3  3ZnCl2 + 2Cr 3ZnCl2 + 2Cr
| 0,37 | |
Pb + Cu(CH3COO)2  Cu + Pb(CH3COO)2 Cu + Pb(CH3COO)2
| 1,90 | |
Fe + CuSO4  FeSO4 + Cu FeSO4 + Cu
| -0,76 | |
AgNO3 + Fe(NO3)2  Fe(NO3)3 + Ag Fe(NO3)3 + Ag
| -21,84 | |
2Cr + 3Cl2  2CrCl3 2CrCl3
| -13,94 | |
2Hg + Ag2SO4  Hg2SO4 + 2Ag Hg2SO4 + 2Ag
| -3,42 | |
2Hg + 2AgCl + H2SO4  Hg2SO4 + 2Ag + 2HCl Hg2SO4 + 2Ag + 2HCl
| 1,91 | |
Cd + Hg2Cl2  CdCl2 + 2Hg CdCl2 + 2Hg
| -2,60 | |
2Ag + Cl2  2AgCl 2AgCl
| -5,99 | |
Zn + CuSO4  ZnSO4 + Cu ZnSO4 + Cu
| -1,37 |
Рассмотрим выполнение каждого задания на примерах.
Пример 3
Найдем ПР(AgCl) при 25 °С.
Способ 1. Составим электрохимическую цепь из серебряного и хлорсеребряного электродов:
AgôAgClôKClôôAgNO3ôAg
Электроды выбирают таким образом, чтобы суммарная реакция в электрохимической цепи выражала равновесный процесс растворения малорастворимого сильного электролита.
Рассмотрим приведенную выше электрохимическую систему как концентрационную серебряную цепь.
Тогда на каждом электроде протекает реакция:
Ag+ + e–  Ag
Ag
Потенциал каждого электрода выражается уравнением Нернста:
j(Ag+/Ag) = j°(Ag+/Ag) + 0,0592×lga(Ag+)
Однако на левом электроде ионы серебра образуются при диссоциации хлорида серебра, и их активность связана с произведением растворимости этого электролита. Поскольку хлорид серебра находится в концентрированном растворе хлорида калия, активность ионов серебра удобно выразить через активность хлорид-ионов:
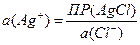
Тогда выражение для потенциала левого электрода можно представить в таком виде:
jлев= j°(Ag+/Ag) + 0,0592×lg 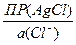 =
=
= j°(Ag+/Ag) + 0,0592×lgПР(AgCl) + 0,0592×lg 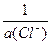
С другой стороны, поскольку на левом электроде ионы серебра связаны с реакцией: Ag+ + Cl–  AgCl, то весь процесс на нем можно представить так:
AgCl, то весь процесс на нем можно представить так:
Ag+ + e–  Ag,
Ag,
–
Ag+ + Cl–  AgCl,
AgCl,
––––––––––––––––––
AgCl + e–  Ag + Cl–
Ag + Cl–
Для последней реакции, полученной при вычитании из первого уравнения второго, уравнение для электродного потенциала соответствует уравнению Нернста для хлорсеребряного электрода:
jлев= j°(AgCl/Ag) + 0,0592×lg 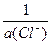 .
.
Сравнивая два выражения для потенциала левого электрода, приходим к уравнению, связывающему ПР(AgCl) со стандартными электродными потенциалами:
j°(AgCl/Ag) = j°(Ag+/Ag) + 0,0592×lgПР(AgCl)
Окончательно получаем расчетную формулу для вычисления произведения растворимости хлорида серебра:
ПР(AgCl) = 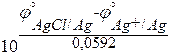
j°(AgCl/Ag) = 0,222 В, j°(Ag+/Ag) = 0,799 В [²Краткий справочник…², табл. 79, стр. 143 – 147].
ПР(AgCl) =  = 1,79×10–10.
= 1,79×10–10.
Растворимостьпредставляет собой концентрацию растворенного вещества в его насыщенном растворе.
Для труднорастворимых сильных электролитов в выражении для произведения растворимости произведение активностей можно заменить произведением молярных концентраций.
В общем случае для равновесия растворения труднорастворимого сильного электролита
MmAa(кр) 
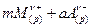
выражение для произведения растворимости имеет вид:
ПР(MmAa) = 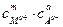 = (mc)m×(ac)a = mm×aa×cm+a,
= (mc)m×(ac)a = mm×aa×cm+a,
где с – молярная концентрация электролита в его насыщенном растворе, которая выражается так:
с(MmAa) = 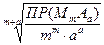
Для 1,1-зарядного электролита MA:
c(MA) = 
s(AgCl) = 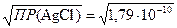 =1,34×10–5 моль/л.
=1,34×10–5 моль/л.
Таким образом, растворимость хлорида серебра в воде при 25 °С составляет 1,34×10–5 моль/л.
Способ 2. Произведение растворимости можно также рассчитать по известным значениям стандартной энергии Гиббса образования ионов в водных растворах при 25 °С.
Так, для равновесия растворения хлорида серебра
Ag+(р) + Cl–(р)  AgCl(кр)
AgCl(кр)
значения DfG° при 298,15 К следующие [²Краткий справочник…², табл. 44, стр. 89 – 91]:
| Ион | Ag+(р) | Cl–(р) |
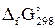 , кДж/моль , кДж/моль
| 77,10 | –131,29 |
В том же справочнике находим 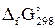 (AgCl(кр)) = –109,54 кДж/моль.
(AgCl(кр)) = –109,54 кДж/моль.
Рассчитаем изменение стандартной энергии Гиббса в ходе рассматриваемой реакции:
 =
= 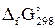 (AgCl(кр)) –
(AgCl(кр)) – 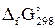 (Ag+(р)) –
(Ag+(р)) – 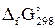 (Cl–(р)) =
(Cl–(р)) =
= –109,54 – 77,10 – (–131,29) = –55,35 кДж/моль.
Запишем уравнение изотермы химической реакции для стандартных условий:
DrG° = –RTlnKа
Выражение константы равновесия через активности ионов:
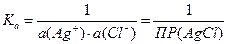
Следовательно,
DrG° = RT·lnПР(AgCl)
Откуда выражаем произведение растворимости:
ПР(AgCl) = 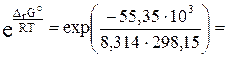 2,01·10–10.
2,01·10–10.
Пример 4
Выполнение задания 4 рассмотрим для следующих исходных данных:
| A | B | M1 | C | D | M2 | a(A) | a(B) | a(C) | a(D) |
| Cr2O72– | Cr3+ | Pt | O2 | H+ | Pt | 0,01 | 0,05 | 0,5 | 0,1 |
Составим формулы электродов и электрохимической цепи. В нашем примере формулы электродов записывают так:
Cr2O72–, Cr3+ôPt
H+, H2OôO2ôPt
Схема электрохимической цепи, составленной из этих электродов:
PtôO2ôH+, H2OôôCr2O72–, Cr3+ôPt
2) Реакции, протекающие на электродах, и уравнение реакции для электрохимической цепи в целом имеют следующий вид:
2×½ Cr2O72– + 14H+ + 6e–  2Cr3+ + 7H2O,
2Cr3+ + 7H2O,
–
3×½ O2 + 4H+ + 4e–  2H2O,
2H2O,
––––––––––––––––––––––––––––––––––––
2Cr2O72– + 16H+  4Cr3+ + 3O2 + 8H2O
4Cr3+ + 3O2 + 8H2O
3) ЭДС электрохимической цепи рассчитаем по уравнению Нернста:
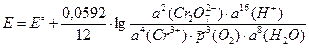
Стандартную ЭДС найдем по определению (3.1) как разность стандартных электродных потенциалов правого и левого электродов:
E° = j°прав – j°лев = 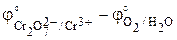 = 1,33 – 1,229 = 0,10 В.
= 1,33 – 1,229 = 0,10 В.
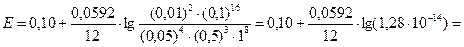
= 0,10 – 0,07 = 0,03 В.
4) Изменение стандартной энергии Гиббса в ходе электрохимической реакции вычислим по уравнению (3.4):
DG° = – zFE° = – 12×96485 Кл/моль×0,101 В = – 116940 Дж/моль.
Аналогичное уравнение справедливо также для нестандартных условий:
DG = – zFE = – 12×96485 Кл/моль×0,03 В = – 37050 Дж/моль.
5) Константу равновесия можно выразить из уравнения (3.3) для стандартного химического сродства:
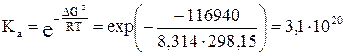
Для изменения направления тока на обратное необходимо, чтобы E ≤ 0:
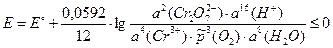
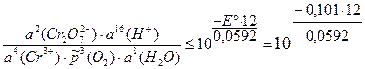 = 3,4×10–21.
= 3,4×10–21.
Пример 5
Рассмотрим выполнение задания 5 для реакции:
H2 + 2AgCl = 2Ag + 2HCl,
для которой 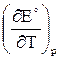 = – 6,45∙10-4 В/К.
= – 6,45∙10-4 В/К.
1) Для составления формулы электрохимической цепи необходимо подобрать две полуреакции, из которых методом алгебраического суммирования можно получить вышеприведенное уравнение.
2×½ AgCl + e– 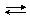 Ag + Cl–,
Ag + Cl–,
–
1×½ 2H+ + 2e– 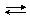 H2(г),
H2(г),
––––––––––––––––––––––––
2AgCl + H2 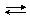 2Ag + 2HCl
2Ag + 2HCl
Составим электрохимическую цепь, в которой протекает данная реакция:
CuôPtôH2ôHClôAgClôAgôCu
2) Найдем термодинамические характеристики указанной реакции.
Изменение энтропии в ходе электрохимической реакции определим по уравнению (3.6):
DrS° = 2×96485 Кл/моль×(-6,45×10-4 В/К) = -124,40 Дж/(моль×К).
Рассчитаем E° по определению (3.1):
E° = j°прав – j°лев = 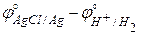 = 0,2222 – 0,0000 =
= 0,2222 – 0,0000 =
= 0,2222 В.
Вычислим DrG°, DrH° и максимальную полезную работу W¢max, применяя формулы (3.4), (3.8) и (3.9) соответственно.
DrG° = –2×96485 Кл/моль×0,2222 В = –42878 Дж/моль;
DrH° = –42878 + 298,15×(–124,40) = –79968 Дж/моль.
Для обратимо работающей электрохимической цепи:
W¢max = 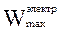 = –(DrG)p,T = z×F×E = 42878 Дж/моль.
= –(DrG)p,T = z×F×E = 42878 Дж/моль.
3) Тепловой эффект электрохимической реакции определяем согласно второму началу термодинамики (3.7):
Qp = T×DrS° = 298,15×(–124,40) = –37090 Дж/моль.
Поскольку Qp< 0 и 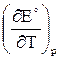 < 0, в адиабатических условиях электрохимическая цепь будет нагреваться, а в изотермических условиях — выделять теплоту в окружающую среду.
< 0, в адиабатических условиях электрохимическая цепь будет нагреваться, а в изотермических условиях — выделять теплоту в окружающую среду.
Обратите внимание на то, что Qp ¹ DrH, т.к. при протекании в электрохимической цепи реакции совершается электрическая работа.
4) Изменение внутренней энергии в ходе реакции найдем, используя первое начало термодинамики:
DrU° = Qp – Wрасш. – W¢ = T×DrS° – p×DV – (–DrG°)p,T = (T×DrS° + DrG°) –
– Dn×RT = DrH° – Dn×RT,
где Dn – алгебраическая сумма стехиометрических коэффициентов газообразных участников реакции.
DrU° = –79968 – (–1)×8,314×298,15 = –77489 Дж/моль.
КОНТРОЛЬНЫЕ ВОПРОСЫ
Вопросы к первому заданию
1.Можно ли для расчета среднего ионного моляльного коэффициента активности g± воспользоваться предельным законом Дебая–Хюккеля? В каком концентрационном диапазоне применим этот закон?
1.Почему при рассмотрении свойств реальных растворов вместо концентрации используют активность?
1.Какие методы используют для определения коэффициентов активности ионов?
Вопросы ко второму заданию
1.В чем различие между сильными и слабыми электролитами? Какая величина является количественной характеристикой силы электролита?
1.Изобразите графически зависимости удельной и молярной электрических проводимостей от концентрации электролитов. Объясните характер этих зависимостей.
1.Что называется константой кислотности? Чем это понятие отличается от константы диссоциации?
Вопросы к третьему заданию
1.С чем связано некоторое отличие значений произведения растворимости, рассчитанных разными способами? Какой метод расчета ПР точнее?
1.От каких факторов зависит ПР? Будет ли влиять внешнее давление на величину ПР?
1.Составьте формулу концентрационной электрохимической цепи, пригодной для определения константы автопротолиза воды, называемого ионным произведением воды. К какому типу относятся электроды, образующие такой элемент?
Вопросы к четвертому заданию
1.Может ли стандартная ЭДС электрохимической цепи быть отрицательной величиной?
1.Сформулируйте стандартные условия для реакции, протекающей в электрохимической цепи.
1.Почему состояние химического равновесия в электрохимической цепи характеризуют константой равновесия Ka, а не Kс? Как связаны эти величины?
Вопросы к пятому заданию
1.Каков физический смысл температурного коэффициента ЭДС?
1.Обладает ли теплота электрохимической реакции свойствами функции состояния? Дайте обоснованный ответ.
1.
| |
Дата добавления: 2017-08-01; просмотров: 319;
