Окисление загрязнителей сточных вод
Окислительный метод очистки применяют для обезвреживания производственных сточных вод, содержащих токсичные примеси (цианиды, комплексные цианиды меди и цинка) или соединения, которые нецелесообразно извлекать из сточных вод, а также очищать другими методами (сероводород, сульфиды).
Для очистки сточных вод используют следующие окислители: газообразный и сжиженный хлор, диоксид хлора, хлорат кальция, гипохлориты кальция и натрия, перманганат калия, бихромат калия, пероксид водорода, кислород воздуха, пероксосерные кислоты, озон, пиролюзит и др.
В процессе окисления токсичные загрязнения, содержащиеся в сточных водах, в результате химических реакций переходят в менее токсичные, которые удаляют из воды.
Активность вещества как окислителя определяется величиной окислительного потенциала. Первое место среди окислителей занимает фтор, который из-за высокой агрессивности не может быть использован на практике. Для других веществ величина окислительного потенциала равна: для озона - 2,07; для хлора - 0,94; для пероксида водорода - 0,68; для перманганата калия - 0,59.
Окисление активным хлором. Хлор и вещества, содержащие активный хлор, являются наиболее распространенными окислителями. Их используют для очистки сточных вод от сероводорода, гидросульфида, метилсернистых соединений, фенолов, цианидов и др.
При введении хлора в воду образуется хлорноватистая и соляная кислоты:
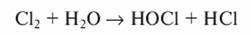
Окисление цианидов хлором можно проводить только в щелочной среде (pH >9...10)
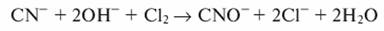
Образующиеся цианаты можно окислить до элементарного азота и диоксида углерода:
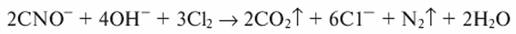
При наличии в сточной воде аммиака, аммонийных солей или органических веществ, содержащих аминогруппы, хлор, хлорноватистая кислота и гипохлориты вступают с ними в реакцию, образуя моно- и дихлорамины, а также треххлористый азот:
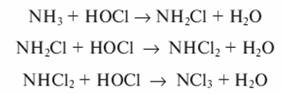
Окисление кислородом воздуха. Реакция окисления кислородом идет в жидкой фазе при повышенных температуре и давлении. При окислении сточных вод целлюлозных, нефтеперерабатывающих и нефтехимических производств протекают следующие реакции:
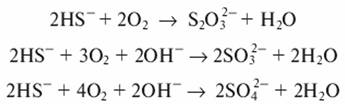
С повышением температуры и давления скорость реакции и глубина окисления сульфидов и гидросульфидов увеличиваются.
Кислород воздуха используют также при очистке воды от железа. В этом случае реакция окисления в водном растворе протекает по схеме
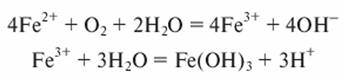
Осуществить процесс разрушения сульфидных соединений можно также диоксидом углерода, содержащимся в отходящих дымовых газах. Образование карбонатов происходит по следующим уравнениям:
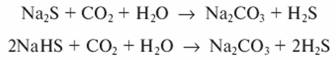
Выделяющийся сероводород, выносимый дымовыми газами и паром, направляется на сжигание, а при использовании диоксида углерода он служит сырьем для получения серной кислоты.
Озонирование. Озон - сильный окислитель, обладающий способностью разрушать в водных растворах при нормальной температуре многие органические вещества и примеси. Окисление озоном позволяет одновременно обеспечить обесцвечивание воды, устранение привкусов и запахов и обеззараживание. Озон окисляет как неорганические, так и органические вещества, растворенные в сточной воде. Озонированием можно очищать сточные воды от фенолов, нефтепродуктов, сероводорода, соединений мышьяка, ПАВ, цианидов, красителей, канцерогенных ароматических углеводородов, пестицидов и др. При обработке воды озоном происходит разложение органических веществ и обеззараживание воды; бактерии погибают в несколько тысяч раз быстрее, чем при обработке воды хлором.
При проведении реакции окисления сероводорода на первой стадии наблюдается выделение серы, а на второй - окисление непосредственно до H2SO4:
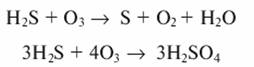
Реакции протекают одновременно, но при избытке озона преобладает вторая.
При окислении цианидов протекают следующие реакции:
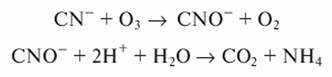
Действие озона в процессах окисления может происходить в трех различных направлениях: непосредственное окисление с участием одного атома кислорода; присоединение целой молекулы озона к окисляемому веществу с образованием озонидов; каталитическое усиление окисляющего воздействия кислорода, присутствующего в озонированном воздухе. Окисление веществ может быть прямое и непрямое, а также осуществляться катализом и озонолизом.
Кинетика прямых реакций окисления может быть выражена уравнением
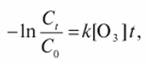 (12.2)
(12.2)
где С0, Сt - начальная и конечная концентрация вещества, мг/л; к - константа скорости реакции, л/(моль·с); [O3] - средняя концентрация озона во время прохождения реакции, мг/л; t - продолжительность озонирования, с.
Непрямое окисление - это окисление радикалами, образующимися в результате перехода озона из газовой фазы в жидкость и его саморазложения.
Озонолиз представляет собой процесс фиксации озона на двойной или тройной углеродной связи с последующим ее разрывом и образованием озонидов, которые, как и озон, являются нестойкими соединениями и быстро разлагаются.
Озонирование представляет собой процесс абсорбции, сопровождаемый химической реакцией в жидкой фазе. Расход озона M, кг/с, необходимого для окисления загрязнений, может быть определен по уравнению массообмена:
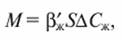 (12.3)
(12.3)
где 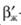 - коэффициент массоотдачи в жидкой фазе при протекании в ней химической реакции, м/с; S - поверхность контакта фаз, м2; ΔСЖ - движущая сила процесса, кг/м3.
- коэффициент массоотдачи в жидкой фазе при протекании в ней химической реакции, м/с; S - поверхность контакта фаз, м2; ΔСЖ - движущая сила процесса, кг/м3.
Процесс очистки сточных вод значительно увеличивается при совместном использовании ультразвука и озона, ультрафиолетового облучения и озона. Ультрафиолетовое облучение ускоряет окисление в 102...104 раз.
Электрохимическое окисление. Электрохимические методы очистки основаны на электролизе производственных сточных вод. Химические превращения при электролизе могут быть весьма различными в зависимости от вида электролита, а также материала электродов и присутствия различных веществ в растворе. Основу электролиза составляют два процесса: анодное окисление и катодное восстановление.
Электрохимическую обработку целесообразно применять при очистке концентрированных органических и неорганических загрязнений и небольших расходах сточных вод.
В качестве анода используют электролитически нерастворимые материалы (уголь, графит, магнетит, диоксиды свинца, магния, рутения), нанесенные на титановую основу, в качестве катода - свинец, цинк и легированную сталь. Большое значение при электрохимическом окислении имеет плотность тока.
Чтобы предотвратить смешение продуктов электролиза, особенно газов (водорода и кислорода), которые могут образовать взрывоопасные смеси, применяют керамические, полиэтиленовые, асбестовые и стеклянные диафрагмы, разделяющие анодное и катодное пространство.
В процессе анодного окисления происходит деструкция органических веществе получением промежуточных или конечных продуктов окисления (органических кислот, СO2, Н2O).
При электролизе щелочных сточных вод, содержащих цианиды, на аноде происходит окисление цианид-ионов с образованием цианат-ионов и дальнейшим их электрохимическим окислением до конечных продуктов:
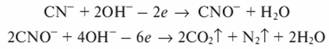
В целях повышения электропроводимости сточных вод, снижения расхода электроэнергии и интенсификации процесса окисления веточные воды добавляют минеральные соли. Наиболее эффективно добавление хлорида натрия, который разлагается с выделением на аноде атомов хлора, участвующих в процессе окисления:
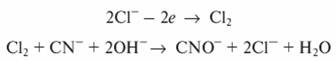
Радиационное окисление. При действии излучений высоких энергий на водные среды, содержащие различные органические вещества, возникает большое число окислительных частиц, обусловливающих процессы окисления. Радиационно-химические превращения протекают не за счет радиолиза загрязняющих воду веществ, а за счет реакции этих веществ с продуктами радиолиза воды: ОН-, НO2- (в присутствии кислорода), Н2O2, Н+ и егидр (гидратированный электрон), первые три из которых являются окислителями. В качестве источников излучения могут быть использованы радиоактивные кобальт и цезий, тепловыделяющие элементы, радиационные контуры, ускорители электронов.
Дата добавления: 2017-06-02; просмотров: 3566;
