Уравнение Ван-дер-Ваальса
Как уже указывалось в § 60, для реальных газов необходимо учитывать размеры молекул и их взаимодействие друг с другом, поэтому модель идеального газа и уравне-
нне Клапейрона — Менделеева (42.4) pVm=RT (для моля газа), описывающее идеальный газ, для реальных газов непригодны.
Учитывая собственный объем молекул и силы межмолекулярного взаимодействия, голландский физик И. Ван-дер-Ваальс (1837—1923) вывел уравнение состояния реального газа. Ван-дер-Ваальсом в уравнение Клапейрона — Менделеева введены две поправки.
1. Учет собстииии объема молекул. Наличие сил отталкивания, которые проти
водействуют проникновению в занятый молекулой объем других молекул, сводится
к тому, что фактический свободный объем, в котором могут двигаться молекулы
реального газа, будет не Vm, a Vm—b, где b — объем, занимаемый самими молекулами.
Объем bравен учетверенному собственному объему молекул. Если, например, в сосуде находятся две молекулы, то центр любой из них не может приблизиться к центру другой молекулы на расстояние, меньшее диаметра d молекулы. Это означает, что для центров обеих молекул оказывается недоступным сферический объем радиуса d, т. е. объем, равный восьми объемам молекулы или учетверенному объему молекулы в расчете на одну молекулу.
2. Учет притяжения молекул. Действие сил притяжения газа приводит к появлению
дополнительного давления на газ, называемого внутренним давлением.По вычислени
ям Ван-дер-Ваальса, внутреннее давление обратно пропорционально квадрату моляр
ного объема, т. е.
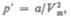 (61.1)
(61.1)
где а — постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения, Vm — молярный объем.
Вводя эти поправки, получим уравнение Ван-дер-Ваальса для моля газа (уравнение состояния реальных газов):
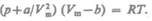 (61.2)
(61.2)
Для произвольного количества вещества 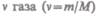 с учетом того, что
с учетом того, что 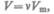
Дата добавления: 2017-04-20; просмотров: 452;
