Которая определяется только состоянием системы и не зависит от пути, каким система пришла в это состояние. Таким образом,
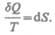 (57.2)
(57.2)
Функция состояния, дифференциалом которой является 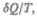 называется энтропией
называется энтропией
и обозначается S.
Из формулы (57.1) следует, что для обратимых процессов изменение энтропии
 (57.3)
(57.3)
В термодинамике доказывается, что энтропия системы, совершающей необратимый цикл, возрастает:
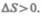 (57.4) Выражения (57.3) и (57.4) относятся только к замкнутым системам, если же система
(57.4) Выражения (57.3) и (57.4) относятся только к замкнутым системам, если же система
Обменивается теплотой с внешней средой, то ее энтропия может вести себя любым образом. Соотношения (57.3) и (57.4) можно представить в виде неравенства Клаузиуса
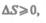 (57.5)
(57.5)
т. е. энтропия замкнутой системы может либо возрастать (в случае необратимых процессов), либо оставаться постоянной (в случае обратимых процессов).
Если система совершает равновесный переход из состояния 1 в состояние 2, то, согласно (57.2), изменение энтропии
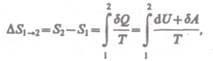 (57.6)
(57.6)
где подынтегральное выражение и пределы интегрирования определяются через величины, характеризующие исследуемый процесс. Формула (57.6) определяет энтропию лишь с точностью до аддитивной постоянной. Физический смысл имеет не сама энтропия, а разность энтропии.
Дата добавления: 2017-04-20; просмотров: 604;
