Особые случаи электропроводности электролитов.
Ионы водорода (гидроксония) и гидроксила обладают аномально высокой подвижностью. Из сравнения данных таблиц 6.1 и 6.2 видно, что их подвижность приблизительно на порядок выше, чем у остальных ионов.
Таблица 6.2
Подвижности ионов водорода и гидроксила.
| Ион | 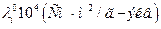
| ||||
| 0°С | 18°С | 25°С | 45°С | 100°С | |
| H+ OH- | - |
Причина заключается в структуре молекул воды, их упорядоченном расположении и наличии большого числа водородных связей.
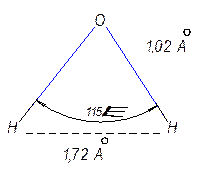
Рис. 6.5 Структура молекулы воды.
Ион водорода H+окружён гидратной оболочкой из молекул воды. Чаще всего этот ассоциат имеет состав H9O4+.Механизмэлектропроводности можно проиллюстрировать следующим уравнением:
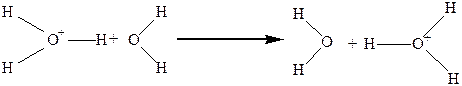
(6.б)
Вначале молекула разворачивается, а затем происходит туннельный переход, то есть по существу осуществляется только перенос заряда по эстафетному механизму. Этим и обусловлена высокая подвижность иона водорода.
Очень часто зависимость эквивалентной электропроводности от концентрации отличается от приведенной на рис. 6.1 и имеет гораздо более сложный характер (рис. 6.6).
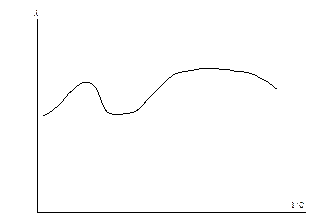
Рис. 6.6 Аномальная зависимость эквивалентной электропроводности от разбавления.
В этом случае при определённых концентрациях возможно образование ассоциатов, которые распадаются при разбавлении. Поэтому электропроводность необходимо всегда определять экспериментально.
Причиной образования ассоциатов и их распада являются взаимодействия растворителя и растворенного вещества, а также образование и разрыв водородных связй.
Вопросы и задачи
Пример 1
Удельная электропроводность 0,135 моль/л раствора пропионовой кислоты C2H5COOH равна 4,79×10-2 См/м. Рассчитать эквивалентную электропроводность раствора, константу диссоциации кислоты и pH раствора, если предельные подвижности H+ и C2H5COO- равны 349,8 См×см2/моль и 37,2 См×см2/моль соответственно.
Решение.
l0 = 349,8 + 37,2 = См×см2 / моль
l = k / С×1000 = 4,79×10-2 См/см / 0,135 моль/л×1000 = 3,55 См×см2/моль
a = l/l0 = 3,55 / 387,0 = 0,009
 =1,15×10-5(моль/л)
=1,15×10-5(моль/л)
[H+] = aC = 1,24×10-3(моль/л)
pH = - lg[H+] = 2,91
Ответ: l = 3,55 См×см2/моль; a = 0,009; K = 1,15×10-5(моль/л); pH = 2,91.
Пример 2
Удельная электропроводность 5% раствора Mg(NO3)2 при 18°С равна 4,38 См/м, а его плотность – 1,038 г/см3. Рассчитать эквивалентную электропроводность раствора и кажущуюся степень диссоциации соли в растворе. Подвижность ионов Mg2+ и 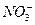 при 18°С равны соответственно 44,6 и 62,6 См×см2/г-экв.
при 18°С равны соответственно 44,6 и 62,6 См×см2/г-экв.
Решение.
 = 0,35 моль/л = 0,7 г-экв/л
= 0,35 моль/л = 0,7 г-экв/л
 =6,25×10-3 (См×см2 / г-экв)
=6,25×10-3 (См×см2 / г-экв)
l0 = 44,6 + 62,6 = 107,2 (См×см2 / г-экв)
a = l / l0 = 62,5 / 107,2 = 0,583
Ответ: l = 6,25×10-3 См×см2 / г-экв; a = 0,583
1. Рассчитать удельную электропроводность дистиллированной воды при 25°С.
2. Эквивалентные электропроводности бесконечно разбавленных растворов KCl, KNO3 и AgNO3 при 25°С равны соответственно 149,9; 145,0 и 133,4 См×м2 / моль. Какова эквивалентная электропроводность бесконечно разбавленного раствора AgCl при той же температуре.
3. Удельная электропроводность 4% водного раствора H2SO4 при 18°C равна 0,168 См/см плотность раствора – 1,026 г/см3. Рассчитать эквивалентную электропроводность раствора.
4. Удельная электропроводность насыщенного раствора AgCl в воде при 25°С равна 2,28×10-4 См/м, а удельная электропроводность воды 1,16×10-4 См/м. Рассчитать растворимость AgCl в воде при 25°С в моль/л.
5.Эквивалентная электропроводность водного раствора сильного электролита при25°С равна 109,9 См×см2 / моль при концентрации 6,2×10-3 моль/л и 106,1 См×см2 / моль при концентрации1,5×10-2 моль/л. Какова эквивалентная электропроводность раствора при бесконечном разбавлении.
Дата добавления: 2017-01-29; просмотров: 3564;
