Методические рекомендации к теме
Неэлектролитами называются вещества, растворы или расплавы которых не проводят электрический ток. К ним относятся вещества с молекулярным строением (большинство органических веществ, газы и т.д.). Разбавленные растворы неэлектролитов обладают рядом коллигативных свойств, которые широко используются для определения молекулярной массы растворенного вещества. Данные свойства выразаются следующими законами: 1) закон Вант-Гоффа: осмотическое давление раствора прямо пропорционально его молярной концентрации: 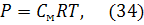 где Р - осмотическое давление раствора, кПа; С - молярная концентрация раствора; R – универсальная газовая постоянная, 8,31 Дж/(моль·К); Т – температура, К; 2) первый закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества:
где Р - осмотическое давление раствора, кПа; С - молярная концентрация раствора; R – универсальная газовая постоянная, 8,31 Дж/(моль·К); Т – температура, К; 2) первый закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества: 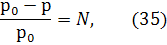 где р0 - давление насыщенного пара над чистым растворителем, р - давление насыщенного пара растворителя над раствором; N – молярная доля растворенного вещества рассчитывается по формуле:
где р0 - давление насыщенного пара над чистым растворителем, р - давление насыщенного пара растворителя над раствором; N – молярная доля растворенного вещества рассчитывается по формуле:
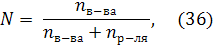 3) второй закон Рауля: повышение температуры кипения и понижение температуры замерзания разбавленных растворов неэлектролитов прямо пропорциональны моляльной концентрации растворенного вещества:
3) второй закон Рауля: повышение температуры кипения и понижение температуры замерзания разбавленных растворов неэлектролитов прямо пропорциональны моляльной концентрации растворенного вещества: 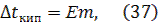
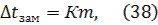 где Е - эбуллиоскопическая постоянная, К – криоскопическая постоянная, m – моляльная концентрация, моль/кг. Моляльная концентрация (моляльность) показывает, какое количество растворенного вещества содержится в 1 кг растворителя. Ее можно рассчитывать по формуле:
где Е - эбуллиоскопическая постоянная, К – криоскопическая постоянная, m – моляльная концентрация, моль/кг. Моляльная концентрация (моляльность) показывает, какое количество растворенного вещества содержится в 1 кг растворителя. Ее можно рассчитывать по формуле: 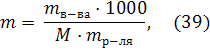 где mв-ва – масса растворенного вещества, г; mр-ля – масса растворителя, г; М – молярная масса вещества, г/моль. 6.3 Примеры решения задач Задача 1.Вычислите осмотическое давление раствора, содержащего в 1,5л 50г глюкозы при 250С. Решение: 1) Рассчитываем молярную концентрацию раствора по формуле 16:
где mв-ва – масса растворенного вещества, г; mр-ля – масса растворителя, г; М – молярная масса вещества, г/моль. 6.3 Примеры решения задач Задача 1.Вычислите осмотическое давление раствора, содержащего в 1,5л 50г глюкозы при 250С. Решение: 1) Рассчитываем молярную концентрацию раствора по формуле 16: 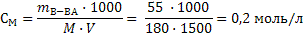 2) Осмотическое давление рассчитываем по формуле 34:
2) Осмотическое давление рассчитываем по формуле 34: 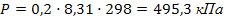 Задача 2.При некоторой температуре давление пара над раствором, содержащем 62г фенола С6Н5ОН в 60 молях эфира, равно 50,7 кПа. Определите давление пара эфира при этой температуре. Решение: 1) Рассчитываем количество фенола:
Задача 2.При некоторой температуре давление пара над раствором, содержащем 62г фенола С6Н5ОН в 60 молях эфира, равно 50,7 кПа. Определите давление пара эфира при этой температуре. Решение: 1) Рассчитываем количество фенола: 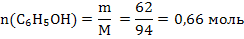 2) Определяем молярную долю фенола по формуле 36:
2) Определяем молярную долю фенола по формуле 36:  3) Из формулы 35 выражаем и рассчитываем давление пара эфира:
3) Из формулы 35 выражаем и рассчитываем давление пара эфира:
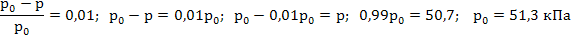 Задача 3. При растворении 6г некоторого неэлектролита в 200г воды температура кипения повышается на 0,26°. Вычислите молярную массу растворенного вещества. Решение: 1) Эбуллиоскопическую константу воды берем из приложения 3. Из формулы 38 выразим и рассчитаем моляльность раствора :
Задача 3. При растворении 6г некоторого неэлектролита в 200г воды температура кипения повышается на 0,26°. Вычислите молярную массу растворенного вещества. Решение: 1) Эбуллиоскопическую константу воды берем из приложения 3. Из формулы 38 выразим и рассчитаем моляльность раствора : 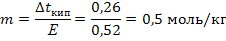 2) Молярную массу выражаем из формулы 39:
2) Молярную массу выражаем из формулы 39: 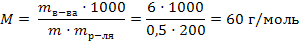
Задача 4.К 4л воды прилили 1л метанола (ρ=0,8 г/мл). Полученный раствор залили в радиатор автомобиля. Рассчитайте минимальную температуру, при которой автомобиль можно оставлять на открытом воздухе не опасаясь, что вода в радиаторе замерзнет. Решение: 1) По известной плотности рассчитаем массу метанола: 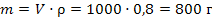 Так как плотность воды равна 1 г/мл, масса воды равна 4000г 2) Рассчитаем моляльность полученного раствора по формуле 39:
Так как плотность воды равна 1 г/мл, масса воды равна 4000г 2) Рассчитаем моляльность полученного раствора по формуле 39: 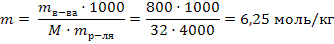 3) По закону Рауля (38) рассчитываем понижение температуры замерзания:
3) По закону Рауля (38) рассчитываем понижение температуры замерзания:  Криоскопическую константу берем из приложения 3. 4) Так как температура замерзания воды равна 00С, температура замерзания раствора tзам = 0 – 11,625 = -11,6250С. Следовательно автомобиль можно на открытом воздухе оставлять до -100С.
Криоскопическую константу берем из приложения 3. 4) Так как температура замерзания воды равна 00С, температура замерзания раствора tзам = 0 – 11,625 = -11,6250С. Следовательно автомобиль можно на открытом воздухе оставлять до -100С.
6.4 Практическое занятие №4 «Коллигативные свойства растворов»
Цель: изучить физико-химические свойства растворов неэлектролитов и их практическое применение, отработать навыки расчетов осмотического давления, температур кипения и температур замерзания растворов неэлектролитов. Вопросы для обсуждения: 1. Что называют электролитами и неэлектролитами? Приведите примеры. 2. Чем объяснить поведение разбавленных растворов неэлектролитов подобное идеальным газам? 3. Что называют насыщенным паром? Сформулируйте 1 закон Рауля? Приведите математическое выражение закона. 4. Дайте определение молярной доли растворенного вещества и молярной концентрации раствора. 5. Что называют повышением температуры кипения? Понижением температуры замерзания? Сформулируйте 2 закон Рауля? Приведите математическое выражение закона. 6. Что такое эбуллиоскопическая и криоскопическая постоянные? Как они обозначаются и от чего зависят? 7. Что называют моляльной концентрацией? По какой формуле ее рассчитывают? 8. Что такое осмос? Осмотическое давление? 9. Приведите формулировку закона Вант-Гоффа. 10. Каково значение осмоса в природе? Какие растворы называют изотоническими? Гипертоническими? Гипотоническими? Упражнения и задачи для закрепления материала и отработки навыков: 1. К 200 мл 0,1М раствора глюкозы добавили 50 мл воды. Вычислить осмотическое давление полученного раствора глюкозы при 360С. 2. Раствор, в 300 мл которого содержится 3,72г неэлектролита, обладает при 200С осмотическим давлением 487 кПа. Определите молярную массу вещества. 3. Давление водяного пара при 1000С равно 101,33 кПа. Определите давление насыщенного пара над 15%-ным растворов мочевины СО(NH2)2 при 1000С. 4. Раствор, содержащий 1,6г неэлектролита в 250г бензола, замерзает при 5,2450С. Температура замерзания бензола 5,50С. Вычислите молярную массу растворенного неэлектролита. 5. В качестве антифриза используют раствор этиленгликоля (С2Н4(ОН)2), который заливают в радиаторы автомашин в зимнее время. Какую массу этиленгликоля необходимо добавить к 2л воды, чтобы температура замерзания понизилась на 160С? 6. Вычислите температуру кипения 5%-ного водного раствора глицерина C3Н5(OH)3.
6.5 Тесты для самопроверки Тест 1
1. Раствор, содержащий 11,6г ацетона (М=58) в 250г воды (Е=0,52) имеет температуру кипения 1) 104,20С 2) 100,10С 3) 101,040С 4) 100,420 2. Каково осмотическое давление раствора, содержащего 90,08г глюкозы С6Н12О6 в 4л раствора при 270С 1) 3,12∙105 Па 2) 1,25∙105 Па 3) 28∙103 Па 4) 1,12∙105 Па 3. По закону Рауля повышение температуры кипения пропорционально 1) молярной концентрации раствора 2) моляльной концентрации раствора 3) мольной доле растворенного вещества 4) процентной концентрации раствора 4. При растворении в растворителе нелетучего вещества температура замерзания раствора 1) понижается 2) повышается 3) не изменяется 5. Моляльная концентрация показывает 1) число граммов вещества в 1 литре раствора 2) число молей эквивалентов вещества в 1л раствора 3) число молей вещества в 1000 граммах растворителя 4) число граммов вещества в 1 мл раствора 6. 40г гидроксида натрия растворили в 90г воды. Молярная доля гидроксида натрия равна 1) 0,17 2) 0,44 3) 0,31 4) 0,20
7. Моляльная концентрация 10%-ного раствора карбоната натрия равна 1) 0,94 2) 1,05 3) 0,094 4) 0,105 8. Водный раствор глицерина (С3Н8О3) кипит при 100,52 °С. Массовая доля глицерина в растворе равна 1) 4,03 % 2) 3,02 % 3) 2,84 % 4)8,42% 9. Односторонняя диффузия определенного сорта частиц в раствор через полупроницаемую перегородку называется 1) плазмолизом 2) гидролизом 3) осмосом 4) тургором 10. По закону Вант-Гоффа осмотическое давление раствора прямо пропорционально 1) мольной доле растворенного вещества 2) моляльной концентрации раствора 3) массовой доле растворенного вещества 4) молярной концентрации раствора
Тест 2 1. Сколько граммов мочевины (NH2)2СО растворили в 200г воды если температура кипения раствора повысилась на 0,3 градуса 1) 6,92 г 2) 5,74 3) 7,25г 4) 8,72 2. Каково осмотическое давление раствора если при 17°С в 250 мл его содержится 0,2 моль вещества 1) 1678 кПа 2) 1928 кПа 3) 2993 кПа 4)3075кПа 3. Относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного нелетучего вещества – это закон 1) Рауля 2) Вант-Гоффа 3) Генри 4) Гесса 4. Вычислить температуру замерзания раствора, содержащего 20 г сахара С12Н22О11 в 400г воды 1) -0,110С 2) -0,270С 3) 0,110С 4) 0,270С 5. После растворения вещества в растворителе при температуре 200 С давление насыщенного пара растворителя над раствором 1) понижается 2) повышается до критического значения, затем понижается 3) не изменяется 4) повышается 6. Молярная доля растворенного вещества рассчитывается по формуле:
1)  2)
2) 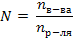 3)
3) 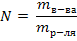 4)
4) 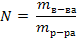 7. Смешали 9,6г метанола и 45г дистиллированной воды. Молярная доля метанола в растворе составляет (в %) 1) 21,3 2) 0,7 3) 12 4) 10,7 8. Число молей растворенного вещества, содержащихся в 1000 г растворителя, называется 1) молярной концентрацией 2) молярной концентрацией эквивалента 3) моляльной концентрацией 4) молярной долей 9. Какова моляльная концентрация 20%-ного раствора хлорида калия: 1) 3,36 2) 2,68 3) 0,336 4) 0,268 10. Какие вещества являются неэлектролитами (указать 2 ответа): 1) поваренная соль 2) сахар 3) этанол 4) калийная селитра
7. Смешали 9,6г метанола и 45г дистиллированной воды. Молярная доля метанола в растворе составляет (в %) 1) 21,3 2) 0,7 3) 12 4) 10,7 8. Число молей растворенного вещества, содержащихся в 1000 г растворителя, называется 1) молярной концентрацией 2) молярной концентрацией эквивалента 3) моляльной концентрацией 4) молярной долей 9. Какова моляльная концентрация 20%-ного раствора хлорида калия: 1) 3,36 2) 2,68 3) 0,336 4) 0,268 10. Какие вещества являются неэлектролитами (указать 2 ответа): 1) поваренная соль 2) сахар 3) этанол 4) калийная селитра
Тема 7. «Свойства растворов электролитов»
7.1 Содержание программы Теория электролитической диссоциации Аррениуса. Сильные электролиты. Коэффициент активности. Ионная сила раствора.Слабые электролиты. Степень и константа диссоциации. Закон разбавления Оствальда.Теория кислот и оснований.
Уровень теоретической и практической подготовки Студент должен усвоить понятия:электролиты, сольватация, гидратация, диссоциация, константа и степень диссоциации; должен знать диссоциацию важнейших классов неорганических соединений. Студент должен уметь предсказывать силу основания и кислоты, пользоваться таблицами констант диссоциации электролитов, вычислять степень диссоциации, концентрацию электролита с учетом степени диссоциации.
7.2 Методические рекомендации к темеВещества, распадающиеся в растворах или расплавах на ионы, называются электролитами.К ним относятся вода, соли, кислоты, основания. Растворы этих веществ сильно отклоняются от законов Рауля и Вант-Гоффа. Причиной этого является диссоциация электролитов на ионы. Процесс электролитической диссоциации обусловлен взаимодействием растворенных веществ с водой (или другим растворителем); образующиеся ионы - катионы и анионы - являются гидратированными, т.е. химически связанными с водой. Необходимо разобраться, как диссоциируют важнейшие электролиты. При диссоциации кислот всегда образуются ионы водорода H+ (точнее ионы гидроксония H3O+), которые обусловливают важнейшие свойства кислот: кислый вкус, изменение окраски индикаторов, взаимодействие с основаниями HNO3 ↔ H+ + NO3- Двух и многоосновные кислоты диссоциируют ступенчато, постепенно отщепляя ионы водорода. Например, в случае серной кислоты первая ступень H2SO4 ↔ H+ + НSO4−, вторая ступень HSО4- ↔ Н+ + SO42- При составлении уравнений диссоциации необходимо помнить, что сумма зарядов катионов равна общей сумме зарядов анионов! При диссоциации оснований всегда образуются гидроксид-ионы OH–, например NaOH ↔ Na+ + OH–. Двух и трехкислотные основания в водных растворах диссоциируют ступенчато, т.е. постепенно отщепляют гидроксид-ионы. Например, в случае гидроксида кальция Ca(OH)2 диссоциация протекает в две ступени: первая ступень Ca(OH)2 ↔ Ca(OH)+ + OH–, вторая ступень Ca(OH)+ ↔ Ca2+ + OH–. Существуют электролиты, которые могут диссоциировать, как по механизму кислот (с отцеплением ионов H+), так и по механизму оснований (отщепление ионов OH–). Они называются амфотерными электролитами или амфолитами. К амфотерным электролитам относится, например, вода H2O ↔ H+ + OH– , гидроксид цинка 2Н+ + ZnO22 - ↔ Zn(OH)2 ↔ Zn2+ + 2OH - как кислота как основание. При диссоциации средних солей образуются катионы металлов и анионы кислотных остатков, например Na2SO4 ↔ 2Na+ + SO42- Диссоциация кислых солей протекает ступенчато, как, например, в случае гидрокарбоната натрия: первая ступень NaHCO3 ↔ Na+ + HCO3- , вторая ступень НСО3- ↔ Н+ + СО32-. В результате образуется два типа катионов: катионы металла и ионы водорода. Также ступенчато диссоциируют основные соли, например, хлорид гидроксомагния: первая cтупень МgOHCI ↔ MgOH+ + CI- вторая ступень MgOH+ ↔ Mg2+ + OH- Таким образом, при диссоциации основных солей образуются два типа анионов: анионы кислотных остатков и гидроксид-ионы. По способности к диссоциации электролиты условно делятся: 1. Сильные электролиты - вещества, диссоциирующие при растворении полностью на ионы. В водных растворах сильными электролитами являются кислоты: азотная, серная, соляная, хлорная, бромоводородная, иодоводородная; щелочи: KOH, NaOH, LiOH, CsOH, RbOH, Ca(OH)2, Ba(OH)2, Sr(OH)2; хорошо растворимые соли. Концентрация ионов в растворе сильного электролита достаточно высока и между ними возникают силы взаимодействия. Для описания состояния ионов в растворе введено понятие активности а. Активность – это эффективная концентрация, в соответствии с которой ионы проявляют себя в физико-химических процессах. Связь между молярной концентрацией См и активностью а, выражается уравнением: а = См·f, где f – коэффициент активности иона. Для определения коэффициента активности ионов необходимо рассчитывать ионную силу растворов I. Ионная сила I – это полусумма произведений каждого вида ионов Сi на квадрат заряда иона данного вида z: I = 0,5( С1∙ z12 + С2∙ z22 +… + Cnzn2) = 0,5 ∑ Ci ∙ zi2 (40) В приложении 4 приводятся коэффициенты активности f ионов в зависимости от их заряда и ионной силы раствора. Приближенно f иона можно вычислить также по формуле: 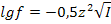 (41)2. Слабые электролиты в растворах диссоциируют частично. К ним относятся вода, кислоты, например: HNO2, HCIO, HCIO2, H2SO3, H2CO3, H2S, CH3COOH; нерастворимые в воде основания, гидроксид аммония NH4OH. В их растворах устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Так, например, в водном растворе азотистой кислоты устанавливается равновесие: HNO2 ↔ H+ + NO2- Процесс диссоциации слабого электролита характеризуется степень и константой диссоциации. Константа диссоциации (Кд) является частным случаем константы равновесия применительно к процессу диссоциации. В данном примере она выглядит так:
(41)2. Слабые электролиты в растворах диссоциируют частично. К ним относятся вода, кислоты, например: HNO2, HCIO, HCIO2, H2SO3, H2CO3, H2S, CH3COOH; нерастворимые в воде основания, гидроксид аммония NH4OH. В их растворах устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Так, например, в водном растворе азотистой кислоты устанавливается равновесие: HNO2 ↔ H+ + NO2- Процесс диссоциации слабого электролита характеризуется степень и константой диссоциации. Константа диссоциации (Кд) является частным случаем константы равновесия применительно к процессу диссоциации. В данном примере она выглядит так:
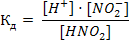 Константы диссоциации слабых кислот и оснований приведены в приложении 5. Чем больше Кд тем сильнее электролит. Степень диссоциации (α) – это число, показывающее какая часть от общего количества электролита распалась на ионы:
Константы диссоциации слабых кислот и оснований приведены в приложении 5. Чем больше Кд тем сильнее электролит. Степень диссоциации (α) – это число, показывающее какая часть от общего количества электролита распалась на ионы:
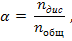 где nдис – количество электролита, распавшегося на ионы, nобщ- общее количество электролита. Степень и константа диссоциации связаны законом разбавления Оствальда:
где nдис – количество электролита, распавшегося на ионы, nобщ- общее количество электролита. Степень и константа диссоциации связаны законом разбавления Оствальда: 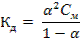 , где См- молярная концентрация электролита. Так как для слабого электролита α « 1, то 1–α ≈ 1 и закон приобретает вид: Кд = α2См (42) 7.3 Примеры решения задач Задача 1.Рассчитайте ионную силу и активность ионов в 0,05М растворе сульфата калия.Решение:1) При диссоциации 1 молекулы сульфата калия образуется 2 иона К+ и 1 ион SO42-: К2SO4 →2К+ + SO42- . Поэтому концентрации ионов ответственно равны: СК+= 0,1моль/л, СSO₄²⁻ = 0,05 моль/л. 2) Рассчитаем ионную силу раствора по формуле (40):
, где См- молярная концентрация электролита. Так как для слабого электролита α « 1, то 1–α ≈ 1 и закон приобретает вид: Кд = α2См (42) 7.3 Примеры решения задач Задача 1.Рассчитайте ионную силу и активность ионов в 0,05М растворе сульфата калия.Решение:1) При диссоциации 1 молекулы сульфата калия образуется 2 иона К+ и 1 ион SO42-: К2SO4 →2К+ + SO42- . Поэтому концентрации ионов ответственно равны: СК+= 0,1моль/л, СSO₄²⁻ = 0,05 моль/л. 2) Рассчитаем ионную силу раствора по формуле (40):  3) Коэффициенты активности ионов рассчитаем по формуле 41: lgf(K+) = – 0,5z2√Ī= – 0,5·12√0,15= –0,19; f(K+)= 0,65 lgf(SO4 2-) = – 0,5z2√Ī= – 0,5·22√0,15= – 0,774; f (SO42-) = 0,17 4) Находим активность ионов: а (К+)=0,65·0,1=0,065 моль/л; а(SO42-)=0,17·0,05=0,0085моль/л Задача 2.Вычислить суммарную концентрацию ионов в 0,02М растворе муравьиной кислоты, если степень диссоциации равна 3%. Решение: 1) Согласно уравнению диссоциации НСООН ↔ Н+ + НСОО- концентрации катионов и анионов равны и совпадают с количеством продиссоциировавшей кислоты: [H+]=[HCOO-]=nдис= α· nобщ=0,02·0,03=0,0006 моль/л 2) Находим суммарную концентрацию ионов [H+]+[HCOO-]= 0,0012 моль/л. Задача 3. При какой концентрации раствора степень диссоциации гидроксида аммония будет равна 0,01? Решение: 1) Рассчитываем концентрацию гидроксида аммония по закону разбавления (формула 42):
3) Коэффициенты активности ионов рассчитаем по формуле 41: lgf(K+) = – 0,5z2√Ī= – 0,5·12√0,15= –0,19; f(K+)= 0,65 lgf(SO4 2-) = – 0,5z2√Ī= – 0,5·22√0,15= – 0,774; f (SO42-) = 0,17 4) Находим активность ионов: а (К+)=0,65·0,1=0,065 моль/л; а(SO42-)=0,17·0,05=0,0085моль/л Задача 2.Вычислить суммарную концентрацию ионов в 0,02М растворе муравьиной кислоты, если степень диссоциации равна 3%. Решение: 1) Согласно уравнению диссоциации НСООН ↔ Н+ + НСОО- концентрации катионов и анионов равны и совпадают с количеством продиссоциировавшей кислоты: [H+]=[HCOO-]=nдис= α· nобщ=0,02·0,03=0,0006 моль/л 2) Находим суммарную концентрацию ионов [H+]+[HCOO-]= 0,0012 моль/л. Задача 3. При какой концентрации раствора степень диссоциации гидроксида аммония будет равна 0,01? Решение: 1) Рассчитываем концентрацию гидроксида аммония по закону разбавления (формула 42): 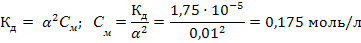
Константу диссоциации гидроксида аммония берем из приложения 5.
7.4 Тесты для самоконтроля Тест 1 1. Какие из указанных веществ являются слабыми электролитами: сернистая кислота, карбонат калия, гидроксид натрия, гидроксид аммония, фосфат кальция, нитрат калия:
1) К2СО3; NaOH; NH4OH 2) КNO3; H2SO3; K2CO3 3) NaOH; Са3(РО4)2; К2СО3 4) Н2SO3; NH4OH; Ca3(PO4)2 2. Какова суммарная концентрация ионов в 0,1М растворе ортофосфата натрия? 1) 0,3 моль/л 2) 0,1 моль/л 3) 0,4 моль/л 4) 0,2 моль/л 3. В растворах каких веществ концентрация ионов водорода наибольшая: 1) СН3СООН 2) Н2SO4 3) Н3РО4 4) НСIO 4. Сколько молекул электролита продиссоциирует из каждых 150 внесенных в раствор, если степень диссоциации равна 20%?
1) 75 2) 150 3) 30 4) 15 5. Вещества, которые при диссоциации образуют в качестве катионов только ионы водорода называются: 1) щелочами 2) кислыми солями 3) кислотами 4) амфотерными гидроксидами 6. В перечне веществ укажите сильные электролиты: гидроксид аммония, азотная кислота, сульфат бария, гидроксид калия 1) гидроксид аммония, азотная кислота 2) сульфат бария, гидроксид калия3) гидроксид аммония, гидроксид калия 4) азотная кислота, гидроксид калия 7. Степень диссоциации гидроксида аммония равна 20%. Какое число гидроксид-ионов приходится в его растворе на каждые 40 нераспавшихся молекул? 1) 10 2)50 3) 25 4) 20 8. Степень диссоциации муравьиной кислоты (Кд=1,77·10-4) в 0,01М растворе равна: 1) 0,133% 2) 13,3% 3) 0,177% 4) 17.7% 9. Какова концентрация водородных ионов в 0,05М растворе уксусной кислоты, если степень диссоциации 0,02: 1) 0,001моль/л 2) 0,01 моль/л 3) 2,5 моль/л 4) 0,25 моль/л 10. Рассчитайте константу диссоциации азотистой кислоты, если в 0,5М растворе она продиссоциировала на 2,93%: 1) 4,3·10-4 2) 4,3 3) 1,47·10-2 4) 1,72·10-3 Тест 2 1. Какие из указанных веществ являются сильными электролитами: 1) Н2SО4; Н2S; Н2SO3 2) HСI; H3PO4; KOH 3) Н2S; H3PO4; Н2SO3 4) KOH; HNO3; Н2SО4 2. Вещество, при диссоциации которого образуются катионы К+ и Н+, а также анионы SO42- является: 1) кислотой 2) щелочью 3) средней солью 4) кислой солью 3. В растворах каких веществ концентрация ионов водорода наибольшая: 1) NaOH 2) H2CO3 3) NH4CI 4) HCI 4. Какова суммарная концентрация ионов в 0,01М растворе сульфата железа (III)? 1) 0,03 моль/л 2) 0,05 моль/л 3) 0,04 моль/л 4) 0,02 моль/л 5. На каждую не распавшуюся молекулу НNO2 приходится три иона Н+ и три иона NO3-. Укажите значение степени диссоциации электролита: 1) 100% 2) 30% 3) 0,754) 0,33 6. Какие из указанных веществ являются слабыми электролитами: серная кислота, карбонат магния, гидроксид натрия, гидроксид аммония, ортофосфорная кислота, нитрат натрия: 1) MgСО3; NaOH; NH4OH 2) NaNO3; H2SO4; MgCO3 3) NaNO3; H3PO4; H2SO4 4) MgCO3; NH4OH; H3PO4 7. Степень диссоциации гидроксида аммония (Кд=1,75·10-5) в 0,05М растворе равна: 1) 1,87% 2) 3,5% 3) 0,0187% 4) 0,187% 8. Какова концентрация ионов водорода в 0,1М растворе серной кислоты: 1) 0,1 моль/л 2) 0,2 моль/л 3) 0,3 моль/л 0,05 моль/л 9. Рассчитайте константу диссоциации уксусной кислоты, если в 0,02М растворе она продиссоциировала на 3%: 1) 1,8·10-2 2) 4,5·10-2 3) 1,8·10-5 4) 1,8·10-3 10. Какова концентрация ионов аммония в 0,05М растворе гидроксида аммония, если степень диссоциации 1%: 1) 0,05 моль/л 2) 5·10-3 моль/л 3) 5·10-4 моль/л 4) 0,2 моль/л Тема 8. «Кислотно-основные свойства веществ»
8.1 Содержание программы Диссоциация воды. Ионное произведение воды. Водородный показатель. Буферные системы. Роль буферных систем в биологических процессах. Понятие гидролиза и его значение. Типы гидролизующихся солей. Применение законов равновесия к гидролизу. Степень и константа гидролиза. Ступенчатый гидролиз.
Уровень теоретической и практической подготовки Студент должен усвоить понятия:ионное произведение воды, водородный и гидроксильный показатели, степень и константа гидролиза; должен знать состав буферных растворов, их свойства и значение, принцип смещения равновесия в применении к гидролизу. Студент должен уметь рассчитывать рН и рОН растворов по известной концентрации водородных (гидроксильных) ионов и наоборот, концентрацию ионов водорода и рН сильных и слабых кислот и оснований, буферных растворов, предсказывать реакцию среды при растворении соли. Студент должен владеть техникой определения рН с помощью индикаторов и иономера.
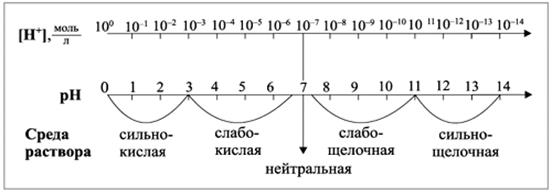
8.2 Методические рекомендации к теме Соотношение концентраций водородных и гидроксильных ионов играет важную роль в самых различных явлениях и процессах: и в природе, и в технике. Нормальное развитие разных сельскохозяйственных культур возможно лишь в определенных интервалах значений рН почвенного раствора. Для снижения кислотности почв применяют известкование (вносят в почву карбонат кальция и карбонат магния), а для снижения щелочности – гипсование (вносят в почву молотый гипс). Водородный показатель рН – это показатель молярной концентрации водородных ионов в растворе, равный отрицательному десятичному логарифму этой концентрации: рН = - lg[H+] (43) Отсюда [H+]=10-рН (44) По значению рН судят о характере среды (рис.1). Гидроксильный показатель рОН – это показатель молярной концентрации гирдроксильных ионов в растворе, равный отрицательному десятичному логарифму этой концентрации: рОН = - lg[ОH-] (45) Отсюда [ОH]=10-рОН (46)
|
| Рисунок 1. Взаимосвязь значений концентрации ионов водорода и рН среды |
Водородный и гидроксильный показатели в растворе взаимосвязаны: рН + рОН = 14 (47) Ионное произведение воды (Кw) – это неизменная при постоянной температуре величина Кw = [H+]·[ОH-]=10-14 (при 220С) (48) Существуют растворы, способные поддерживать рН на определенном уровне – буферные растворы. Они играют очень важную роль в жизни растений и животных. Буферные растворы состоят из слабой кислоты и ее соли образованной сильным основанием, например, ацетатный СН3СООН + СН3СООNа; слабого основания и его соли, образованной сильной кислотой, например аммиачный NН4ОН + NН4Сl; солей слабых многоосновных кислот, например карбонатный NaHCO3+Na2CO3. Формулы для вычисления концентрации водородных ионов [H+] в растворах: сильная одноосновная сильное однокислотное кислота: основание (щелочь): [H+] = CМ к-ты (49) [OH-] = CМ щел. (50)
слабая одноосновная кислота: слабое однокислотное основание: [H+] = 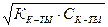 (51) [OH-] =
(51) [OH-] = 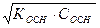 (52)
(52)
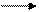
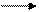 буферный раствор кислотного типа: буферный раствор основного типа: [H+] = Кк-ты
буферный раствор кислотного типа: буферный раствор основного типа: [H+] = Кк-ты 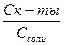 (53) [OH-] = Косн
(53) [OH-] = Косн 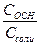 (54) Важным понятием этой темы является гидролиз солей, так как этот процесс имеет большое значение в жизни животных и растений. Ведь усвоение питательных веществ осуществляется в виде ионов – продуктов гидролиза многих солей. Гидролизом солей называется взаимодействие ионов соли с водой, ведущее к образованию слабого электролита. Необходимо отработать навыки составления уравнений гидролиза. Для успешного усвоения достаточно сложного материала целесообразно придерживаться следующего плана: 1) определить, каким основанием и какой кислотой образована соль, используя таблицу растворимости и таблицу констант диссоциации; 2) составить уравнение диссоциации соли; 3) гидролиз пойдет по иону, входящему в состав слабого электролита; 4) составить уравнение реакции взаимодействия этого иона с водой. Это уравнение и будет сокращенным ионным уравнением гидролиза; 5) записать уравнение гидролиза в полной ионной форме. При этом к каждому иону приписать ионы противоположного заряда; 6) заключительным этапом является составление молекулярного уравнения. Пример 1. Составить уравнение гидролиза нитрата меди (II):
(54) Важным понятием этой темы является гидролиз солей, так как этот процесс имеет большое значение в жизни животных и растений. Ведь усвоение питательных веществ осуществляется в виде ионов – продуктов гидролиза многих солей. Гидролизом солей называется взаимодействие ионов соли с водой, ведущее к образованию слабого электролита. Необходимо отработать навыки составления уравнений гидролиза. Для успешного усвоения достаточно сложного материала целесообразно придерживаться следующего плана: 1) определить, каким основанием и какой кислотой образована соль, используя таблицу растворимости и таблицу констант диссоциации; 2) составить уравнение диссоциации соли; 3) гидролиз пойдет по иону, входящему в состав слабого электролита; 4) составить уравнение реакции взаимодействия этого иона с водой. Это уравнение и будет сокращенным ионным уравнением гидролиза; 5) записать уравнение гидролиза в полной ионной форме. При этом к каждому иону приписать ионы противоположного заряда; 6) заключительным этапом является составление молекулярного уравнения. Пример 1. Составить уравнение гидролиза нитрата меди (II):  1) НNO3 сильный электролит
1) НNO3 сильный электролит  Cu(NO3)2 Cu(OH)2 слабый электролит 2) Cu(NO3)2 ↔ Cu2+ + NO3- (I) 3) ион Сu2+ входит в состав слабого электролита, следовательно, гидролиз пойдет по катиону 4) записываем уравнение реакции его с водой: Cu2+ + HOН ↔ (CuOH)+ + H+ Естественно, что ион Сu2+ будет связывать отрицательный ион ОН- из состава воды. Заряд образовавшегося иона CuOH+ равен сумме зарядов Cu2+ и OH-. Связывание ионов ОН- ведет к избытку в растворе ионов Н+, что создает кислую реакцию в растворе 5) к каждому иону приписываем ионы противоположного знака, содержащиеся в растворе (это ионы NO3 -): Cu2+ + 2NO3- + H2O ↔ (CuOH)+ + NO3- + H+ + NO3- 6) объединяя противоположные ионы в молекулы, составляем молекулярное уравнение гидролиза: Cu(NO3)2 + H2O ↔ (CuOH)NO3 + HNO3 Так как ион Cu2+ двухзарядный, то возможна и вторая ступень гидролиза соли. Суть ее состоит во взаимодействии катиона, образовавшегося на первой ступени еще с одной молекулой воды. Все остальные действия повторяются: (CuOH)+ + H2O ↔ Cu(OH)2 +H+ (CuOH)+ + NO3- + H2O ↔ Cu(OH)2 + H+ + NO3- CuOHNO3 + H2O ↔ Cu(OH)2 + HNO3 Пример 2. Гидролиз карбоната калия
Cu(NO3)2 Cu(OH)2 слабый электролит 2) Cu(NO3)2 ↔ Cu2+ + NO3- (I) 3) ион Сu2+ входит в состав слабого электролита, следовательно, гидролиз пойдет по катиону 4) записываем уравнение реакции его с водой: Cu2+ + HOН ↔ (CuOH)+ + H+ Естественно, что ион Сu2+ будет связывать отрицательный ион ОН- из состава воды. Заряд образовавшегося иона CuOH+ равен сумме зарядов Cu2+ и OH-. Связывание ионов ОН- ведет к избытку в растворе ионов Н+, что создает кислую реакцию в растворе 5) к каждому иону приписываем ионы противоположного знака, содержащиеся в растворе (это ионы NO3 -): Cu2+ + 2NO3- + H2O ↔ (CuOH)+ + NO3- + H+ + NO3- 6) объединяя противоположные ионы в молекулы, составляем молекулярное уравнение гидролиза: Cu(NO3)2 + H2O ↔ (CuOH)NO3 + HNO3 Так как ион Cu2+ двухзарядный, то возможна и вторая ступень гидролиза соли. Суть ее состоит во взаимодействии катиона, образовавшегося на первой ступени еще с одной молекулой воды. Все остальные действия повторяются: (CuOH)+ + H2O ↔ Cu(OH)2 +H+ (CuOH)+ + NO3- + H2O ↔ Cu(OH)2 + H+ + NO3- CuOHNO3 + H2O ↔ Cu(OH)2 + HNO3 Пример 2. Гидролиз карбоната калия  H2CO3 cлабый электролит
H2CO3 cлабый электролит  1) K2CO3 KОН сильный электролит 2) K2CO3 ↔ 2K+ + CO32- 3) так как в состав слабого электролита входит ион СО32-, то гидролиз пойдет по аниону 4) записываем уравнение реакции его с водой СО32- + НОН = НСО3- + ОН-Естественно, что отрицательный ион CO32- будет связывать положительный ион Н+. Заряд образовавшегося иона НСО3- равен сумме зарядов СО32- и Н+. Связывание ионов Н+ ведет к избытку ионов ОН- , что определяет щелочную реакцию раствора. 5) СО32- + 2К+ + Н2О ↔ НСО3- + К+ + ОН- + К+ 6) К2СО3 + Н2О ↔ КНСО3 + КОН Так как ион СО32- двухзарядный, то он будет взаимодействовать поочередно с двумя молекулами воды, т.е. возможна II ступень гидролиза: НСО3- + Н2О ↔ Н2СО3 + ОН- НСО3- + К+ + Н2О ↔ Н2СО3 + ОН- + К+ КНСО3 + Н2О ↔ Н2СО3 + КОН Пример 3. Гидролиз нитрита аммония:
1) K2CO3 KОН сильный электролит 2) K2CO3 ↔ 2K+ + CO32- 3) так как в состав слабого электролита входит ион СО32-, то гидролиз пойдет по аниону 4) записываем уравнение реакции его с водой СО32- + НОН = НСО3- + ОН-Естественно, что отрицательный ион CO32- будет связывать положительный ион Н+. Заряд образовавшегося иона НСО3- равен сумме зарядов СО32- и Н+. Связывание ионов Н+ ведет к избытку ионов ОН- , что определяет щелочную реакцию раствора. 5) СО32- + 2К+ + Н2О ↔ НСО3- + К+ + ОН- + К+ 6) К2СО3 + Н2О ↔ КНСО3 + КОН Так как ион СО32- двухзарядный, то он будет взаимодействовать поочередно с двумя молекулами воды, т.е. возможна II ступень гидролиза: НСО3- + Н2О ↔ Н2СО3 + ОН- НСО3- + К+ + Н2О ↔ Н2СО3 + ОН- + К+ КНСО3 + Н2О ↔ Н2СО3 + КОН Пример 3. Гидролиз нитрита аммония:  NH4OH слабый электролит
NH4OH слабый электролит  1) NH4NO2 HNO2 слабый электролит 2) NH4NO2 ↔ NH4+ + NO2- 3) так как оба иона входят в состав слабых электролитов, то оба будут взаимодействовать с водой 4) NH4+ + NO2- + Н2О ↔ NH4OН + НNO2 5) NH4NO2 + Н2О ↔ NH4OН + НNO2
1) NH4NO2 HNO2 слабый электролит 2) NH4NO2 ↔ NH4+ + NO2- 3) так как оба иона входят в состав слабых электролитов, то оба будут взаимодействовать с водой 4) NH4+ + NO2- + Н2О ↔ NH4OН + НNO2 5) NH4NO2 + Н2О ↔ NH4OН + НNO2 
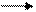 Среда будет зависеть от того, какой электролит сильнее – гидроксид аммония или азотистая кислота. Так как Кд (НNO2) = 4·10 – 4, Кд (NH4OН) = 2·10 – 5 и 4·10 – 4 > 2·10 – 5 среда будет кислая. Необходимо знать, что соли, образованные очень слабым основанием и очень слабой кислотой, могут подвергаться необратимому гидролизу. Например, карбонат железа (III): 3CO2 Fe2(CO3)3 + 6H2O = 2Fe (OH)3↓ + 3H2CO3 3H2O Количественными характеристиками процесса гидролиза являются степень и константа гидролиза. Константа гидролиза (Кг) – это частный случай константы равновесия применительно к реакции гидролиза. Например, для реакции гидролиза нитрата аммония: NH4+ + NO2- + Н2О ↔ NH4OН + НNO2 выражение константы гидролиза имеет вид:
Среда будет зависеть от того, какой электролит сильнее – гидроксид аммония или азотистая кислота. Так как Кд (НNO2) = 4·10 – 4, Кд (NH4OН) = 2·10 – 5 и 4·10 – 4 > 2·10 – 5 среда будет кислая. Необходимо знать, что соли, образованные очень слабым основанием и очень слабой кислотой, могут подвергаться необратимому гидролизу. Например, карбонат железа (III): 3CO2 Fe2(CO3)3 + 6H2O = 2Fe (OH)3↓ + 3H2CO3 3H2O Количественными характеристиками процесса гидролиза являются степень и константа гидролиза. Константа гидролиза (Кг) – это частный случай константы равновесия применительно к реакции гидролиза. Например, для реакции гидролиза нитрата аммония: NH4+ + NO2- + Н2О ↔ NH4OН + НNO2 выражение константы гидролиза имеет вид: 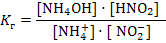 Степень гидролиза (h) показывает какая часть молекул соли подверглась гидролизу:
Степень гидролиза (h) показывает какая часть молекул соли подверглась гидролизу: 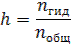 Для расчета степени гидролиза, константы гидролиза и рН растворов солей можно пользоваться формулами таблицы 8.
Для расчета степени гидролиза, константы гидролиза и рН растворов солей можно пользоваться формулами таблицы 8.
Таблица – 8. Формулы для вычисления константы гидролиза, степени гидролиза и рН солей
  Тип соли Тип соли
| Кг | h | рН |
| I. Соли слабых кислот и сильных оснований |
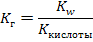
|
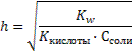
| рН=7+½рКкис+½lgCсоли |
| II.Соли сильных кислот и слабых оснований |
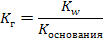
|
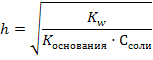
| рН=7-½рКосн-½lgCсоли |
| III.Соли слабых кислот и слабых оснований |
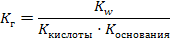
|
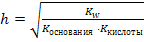
| рН=7+½рКкис-½рКосн |
pK – силовой показатель кислоты или основания. Он равен отрицательному десятичному логарифму константы диссоциации кислоты или основания соответственно: рК = -lgK .8.3 Примеры решения задач Задача 1.Вычистите рН раствора, концентрация гидроксильных ионов в котором 2,65·10-8 моль/л. Решение: 1 cпособ 1) Рассчитываем рОН по формуле 45: рОН = - lg[ОH-]= -lg2,65·10-8 = 8 – lg2,65=8 – 0,42=7,58 2) Так как сумма рН и рОН в растворе равна 14, вычисляем рН: рН=14–7,58=6,42 2 способ 1) Выразим концентрацию ионов водорода из формулы 48: 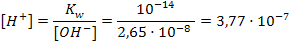 2) По формуле 43 рассчитываем рН: рН = - lg[H+]= - lg3,77·10-7=7-lg3,77=7-0,576=6,42
2) По формуле 43 рассчитываем рН: рН = - lg[H+]= - lg3,77·10-7=7-lg3,77=7-0,576=6,42
Задача 2.Какова концентрация водородных ионов в растворе с рОН = 3,45? Решение: 1 cпособ1) Рассчитываем рН по формуле 47: рН = 14 – рОН = 14 – 3,45= 10,55 2) По формуле 44 вычисляем [Н+]: [H+]=10-рН = 10-10,55 = 10-11·100,45=2,82·10-11
2 cпособ
1) По формуле 46 вычисляем концентрацию гидроксильных ионов: [ОH]=10-рОН=10-3,45=10-4·100,55=3,55·10-4моль/л 2) Концентрацию водородных ионов рассчитываем через ионное произведение воды: 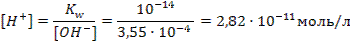
Задача 3.Определите рН 0,008М раствора серной кислоты. Решение: 1) Серная кислота является сильной кислотой, поэтому расчет будем вести по формуле 49 только нужно учесть, что она двухосновная: [H+] = 2·CM(Н2SO4)=2·0,008= 0,016 моль/л 2) Рассчитываем рН: рН = -lg[H+] = -lg0,016 = 1,8
Задача 4.Определите рН 0,03М раствора гидроксида аммония. Решение: 1) Гидроксид аммония является слабым основанием, поэтому используем формулу 52: 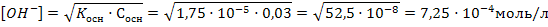 Константу диссоциации гидроксида аммония берем из приложения 5. 2) Рассчитываем рН раствора: рН=14-рОН=14+lg7,25·10-4=14-4+lg7,25=10,86
Константу диссоциации гидроксида аммония берем из приложения 5. 2) Рассчитываем рН раствора: рН=14-рОН=14+lg7,25·10-4=14-4+lg7,25=10,86
Задача 5.Рассчитайте рН раствора, если в 2 л его содержится 6 г уксусной кислоты и 8,2 г ацетата натрия. Решение: 1) Раствор данного состава является буферным кислотного типа, поэтому расчет рН будем производить по формуле 53. Для этого сначала рассчитаем молярные концентрации кислоты и соли: М(СН3СООН)=60г/моль, М(СН3СООNa)=82 г/моль
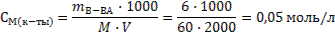
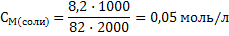 2) Рассчитываем концентрацию водородных ионов и рН :
2) Рассчитываем концентрацию водородных ионов и рН : 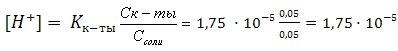 рН=-lg[H+]=-lg1,75·10-5=5-lg1,75=5-0,24=4,76
рН=-lg[H+]=-lg1,75·10-5=5-lg1,75=5-0,24=4,76
Задача 6.Рассчитайте константу и степень гидролиза (%) и рН 0,02М раствора цианида калия при комнатной температуре. Решение: 1) Сначала необходимо установить тип соли. Так как циановодородная кислота слабая, а гидроксид калия щелочь, соль относится к первому типу, и при решении будем использовать соответствующие формулы из таблицы 8:
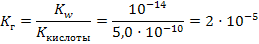
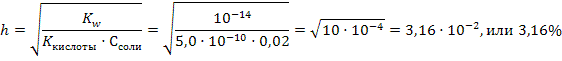 рН=7+½рКкис+½lgCсоли=7-½lg5,0·10-10+½lg0,02=7-½(-10+lg5,0)+½lg0,02=7-+4,65-0,85=10,8
рН=7+½рКкис+½lgCсоли=7-½lg5,0·10-10+½lg0,02=7-½(-10+lg5,0)+½lg0,02=7-+4,65-0,85=10,8
8.4 Лабораторная работа №4 «Экспериментальное определение водородного показателя» Цель работы: изучить способы качественной и количественной оценки реакции среды. Приборы и оборудование: иономер И-500, предметное стекло, капельные пипетки, универсальная индикаторная бумага, штатив с пробирками, химические стаканы емкостью 50 см3. Реактивы: растворы индикаторов лакмуса, фенолфталеина, метилового оранжевого, 0,1 н. растворы гидроксида натрия NaOH, соляной кислоты НСI, уксусной кислоты СН3СООН, водопроводная и дистиллированная вода. Выполнение работы. Опыт 1. Окраска индикаторов в различных средах В три пробирки налейте по 1,5 - 2 см3 дистиллированной воды и добавьте по 2 капле фенолфталеина. В одну пробирку добавьте несколько капель 0,1 н. НС1, в другую - 0,1 н. NaOH. Наблюдайте окраску фенолфталеина в нейтральной, кислой и щелочной средах. После выполнения опыта растворы вылейте, посуду тщательно вымойте. Повторите опыт с использованием индикаторов метилоранжа и лакмуса. Окраску индикаторов запишите в табл.9.
Таблица 9 – Окраска индикаторов в различных средах
| Индикатор | Среда | ||
| кислая | нейтральная | щелочная | |
| фенолфталеин | |||
| метилоранж | |||
| лакмус |
Опыт 2. Определение рН в растворах посредством универсальной индикаторной бумаги На предметное стекло поместите 4 кусочка универсальной индикаторной бумаги, нанесите на каждый по капле исследуемого раствора, сравните изменение окраски с цветной шкалой и определите значение рН. Результаты наблюдений занесите в таблицу 10.
Таблица 10 – Окраска универсальной индикаторной бумаги в различных средах
| № п/п | Исследуемый раствор | Окраска универсальной индикаторной бумаги | рН |
| 0,1 н. НС1 | |||
| 0,1 н. NaOH | |||
| Водопроводная вода | |||
| Дистиллированная вода |
Опыт 3.Определение рН растворов с помощью иономера Ознакомьтесь с правилами работы на иономере. Проведите определение рН растворов на приборе по прилагаемому к нему описанию. Рассчитайте значения концентраций [H+] и [OH-] в исследуемых растворах по результатам значений рН, полученным на иономере. Результаты запишите в сводную таблицу 11.
Таблица 11 – Результаты измерения рН растворов с помощью иономера
| Исследуемый раствор | рН по иономеру | Концентрации | |
| [H+], моль/л | [OH-], моль/л | ||
| 0,1н. НCI | |||
| 0,1н NaOH | |||
| Водопроводная вода | |||
| Дистиллированная вода |
Опыт 4.Определение рН раствора уксусной кислоты Измерьте рН 0,1 н. раствора уксусной кислоты с помощью иономера. Для этого налейте в стакан емкостью 50 см3 анализируемый раствор и поместите его на предметный столик. Опустите электроды в раствор и измерьте рН. Так как уксусная кислота является слабым электролитом, рассчитайте концентрацию гидроксильных ионов в анализируемом растворе по формуле 51: [H+] = 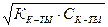 и вычислите рН. Сравните измеренную величину рН и теоретически вычисленное значение. Вычислите относительную ошибку опыта. Вопросы к защите: 1.Что такое водородный показатель? Гидроксильный показатель? Как их обозначают? 2. Как взаимосвязаны водородный и гидроксильный показатели?
и вычислите рН. Сравните измеренную величину рН и теоретически вычисленное значение. Вычислите относительную ошибку опыта. Вопросы к защите: 1.Что такое водородный показатель? Гидроксильный показатель? Как их обозначают? 2. Как взаимосвязаны водородный и гидроксильный показатели?
3. Каковы значения рН в кислой, щелочной и нейтральной средах?
4. Что называется ионным произведением воды? Чему оно равно при 200С? Как изменяется с ростом температуры? 5. Назовите методы определения рН. 6. Приведите примеры влияния рН на биологические и сельскохозяйственные объекты. 7. Что такое буферные растворы? Приведите примеры.
8.5 Практическое занятие №5 «Гидролиз солей. Константа и степень гидролиза. Составление уравнений гидролиза»
Цель: отработка навыков составления уравнений гидролиза солей, расчетов константы, степени гидролиза и рН растворов солей. Вопросы для обсуждения: 1. Что называется гидролизом солей?
1. Соли каких типов подвергаются гидролизу? Приведите примеры. 3. В каких случаях гидролиз солей необратим? Приведите пример. 4. Что называется степенью гидролиза? Какие факторы оказывают существенное влияние на степень гидролиза? 5. От каких факторов зависит константа гидролиза? 6. Как изменится степень гидролиза силиката натрия при подкислении раствора соли.? 7. Гидролиз каких солей протекает в несколько ступеней? Какая ступень гидролиза преобладает? 8. Каково значение гидролиза солей в питании растений? Упражнения и задачи для закрепления материала и отработки навыков: 1. Какие из следующих солей: AlBr3, (NH4)2CO3, (NH4)2S, FeCl2, CoSO4, Na2SiO3, Pb(NO3)2, CH3COONH4 подвергаются гидролизу:
а) по аниону б) по катиону в) по аниону и катиону. Составьте уравнения гидролиза всех солей. 2. Изменится ли равновесие диссоциации воды при растворении:
а) KCl б) Na2S. Ответ обоснуйте, составив соответствующие уравнения гидролиза. 3. Рассчитать степень гидролиза по I ступени для солей K2S и K2CO3 , если концентрации этих солей равны 0,1 моль/л. 4. Вычислить Кг по I ступени для соли Na2S. 5. Изменится ли окраска индикатора фенолфталеина в растворах следующих солей: K3PO4, K2SO3, (NH4)2SO4, AlCl3, KBr? Составьте уравнения гидролиза солей. Растворы каких солей характеризуются значением рН<7? 6. Почему при сливании растворов AlCl3 и Na2CO3 в осадок выпадает гидроксид алюминия? Ответ обосновать составлением уравнения реакции. 7. Рассчитать рН растворов солей KCN, NH4NO3 и NH4NO2 при их концентрациях 0,2 моль/л. Индивидуальное задание: 1)составить молекулярное и ионные уравнения гидролиза указанной соли. В какой цвет окрасит лакмус раствор данной соли. Почему? 2) указать, в какую сторону сместится равновесие гидролиза при подкислении раствора; 3) составить выражение для константы гидролиза; 4) рассчитать степень гидролиза и рН раствора соли. Варианты заданий AlCl3, Na3PO4, К2CO3, CaCl2, Zn(NO3)2, Na2S, KHCO3, CuSO4, Na2SO3, K2SiO3, Mg(NO3)2, FeCl3, Ca(NO2)2, (NH4)2S
8.6 Тесты для самоконтроля Тест 1
Раствор азотной кислоты полностью ионизирован в воде. Чему равно значение рН 0,01М р-ра НNO3?
1) 1 2) 2 3) 10 4) 12 2. Наиболее сильной кислотой из приведенных ниже являются: 1) Н2СО3 2) Н2SO3 3) Н3РО4 4) Н2SO4 3. Раствор имеет рН=5,0. Концентрация [OH-] в нем равна: 1) 10-14 2) 5,0 3) 10-9 4) 10-12 4. Буферными свойствами обладает система, состоящая из : 1) НСI и NaCI 2) NaOH и Na2SO4 3) Н2СО3 и КНСО3 4) НСООН и НСООК 5. Лакмус окрашивает в красный цвет только первой раствор соли для набора 1) хлорид цинка, хлорид натрия 2) сульфат калия, сульфат алюминия 3) сульфит калия, сульфат натрия 4) сульфат цезия, сульфат натрия 6. Во сколько раз концентрация ионов водорода в растворе с рН = 6 больше, чем в растворе с рН = 8: 1) 10 раз 2) 20 раз 3) 100 раз 4) 2 раза 7. Из следующего списка выделите соли слабых кислот: сульфид натрия, сульфат калия, карбонат калия, хлорид магния: 1) Na2S и К2SO4 2) К2СО3 и МgCI2 3) Na2S и К2СО3 4) К2SO4 и МgCI2 8. Растворы каких солей имеют рН > 7: 1) КCI и Na2CO3 2) Na2CO3 и CH3COONa 3) CH3COONa и К2SO4 4) NH4CI и Ca(NO3)2 9. Значение рН раствора, в 1л которого содержится 0,2 моль ацетата аммония и 0,2 моль уксусной кислоты Ка=1,8 ∙10-5, равно 1) 4,742) 5,44 3) 2,72 4) 9,52 10. Для смещения равновесия обратимого гидролиза соли в сторону образования продуктов необходимо 1) увеличить концентрацию соли 2) уменьшить температуру 3) повысить температуру 4) увеличить давление
Тест 2 1. Чему равен рН 0, 1М раствора гидроксида натрия: 1) 1 2) 13 3) 7 4) 2 2 . Ионное произведение воды выражается уравнением
1) 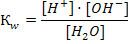 2)
2) 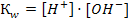 3)
3) 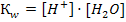 4)
4) 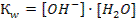 3. Растворы каких солей имеют рН < 7: 1) (NH4)2SO4 и MgCI2 2) NaNO2 и MgCI2 3) K3PO4 и КNO3 4) K3PO4 и NaNO2 4. Во сколько раз концентрация ионов водорода в растворе с рН = 2 больше,
3. Растворы каких солей имеют рН < 7: 1) (NH4)2SO4 и MgCI2 2) NaNO2 и MgCI2 3) K3PO4 и КNO3 4) K3PO4 и NaNO2 4. Во сколько раз концентрация ионов водорода в растворе с рН = 2 больше,
чем в растворе с рН = 5: 1) 100 раз 2) 10 раз 3) 1000 раз 4) 3 раза 5. Для уменьшения степени гидролиза в растворе сульфата железа (II) необходимо 1) добавить кислоты 2) разбавить раствор 3) увеличить температуру 3) добавить щелочи 6. Одним из продуктов гидролиза хлорида алюминия по первой ступени является 1) АlOHCl 2) AlOHCl2 3) Al(OH)2Cl 4) Al(OH)3 7. рН раствора, в 2л которого содержится 0,2 моль уксусной кислоты (Ка=1,8∙10-5), равен 1) 5,9 2) 2,9 3) 7,5 4) 6,5 8. В растворах каких веществ концентрация ионов водорода наибольшая: 1) НCI 2) CH3COOH 3) Н2CO3 4) Н2S 9. Из следующего списка выделите соли слабых кислот: 1) К2SiO3 и CaCI2 2) CH3COONa и NH4NO3 3) K2SiO3 и CH3COONa 4) NH4NO3 и CaCI2 10. Лакмус окрашивает в синий цвет раствор только второй соли для набора 1) хлорид цинка, карбонат натрия 2) сульфат калия, сульфат алюминия 3) сульфат бериллия, сульфат цинка 4) сульфат цезия, сульфат натрия
Тема 9. «Окислительно-восстановительные реакции»
9.1 Содержание программы Понятие окислительно-восстановительных реакций и степени окисления.Сущность теории окислительно-восстановительных реакций.Метод электронного баланса.Классификация окислительно-восстановительных реакций.Важнейшие окислители и восстановители.Направление окислительно-восстановительных реакций. Эквивалент окислителя и восстановителя.
Уровень теоретической и практической подготовки Студент должен знать характер изменения окислительно-восстановительных свойств элементов и простых веществ в периодах и группах периодической системы; формулы веществ, являющихся сильными окислителями и восстановителями; примеры окислительно-восстановительных процессов в биологических объектах и применение в химической технологии. Студент должен уметь рассчитывать эквиваленты веществ в окислительно-восстановительных процессах; по степени окисления элемента в веществе предсказывать его окислительно-восстановительные свойств. Студент должен владеть навыками расчета степени окисления элемента по формуле его соединения и составления формулы по данным степеням окисления; написания уравнений электронного баланса для окислительно-восстановительной реакции и расстановки коэффициентов в уравнении реакции.
Дата добавления: 2017-01-13; просмотров: 1413;
