Лекция 42. Расчет результатов гравиметрического анализа. Фактор пересчета
Ключевые слова: расчет результатов гравиметрического анализа, фактор пересчета.
В гравиметрическом анализе обычно находят не абсолютное количество определяемого компонента, а его содержание (масс. доля, %) в анализируемом веществе. Гравиметрический анализ включает два экспериментальных измерения: взвешивание навески и взвешивание продукта известного состава, полученного из этой навески. На основании этих данных обычно рассчитывают содержание определяемого компонента. Если А – определяемый компонент, можно записать
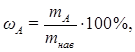
где ωА - массовая доля (%) определяемого компонента;
mнав – масса навески образца анализируемого вещества;
mА – масса определяемого компонента в анализируемом образце.
Например, содержание влаги (влажность) определяют, взвешивая навеску влажного образца до и после высушивания. Массу удаленной при высушивании воды рассчитывают по разности:
m(H2O) = m(влаж нав) - m(сух нав);
m(влаж нав) – масса влажной навески анализируемого вещества;
m(сух нав)– масса этой же навески после высушивания.
Содержание воды (влаги, влажность) рассчитывают по соотношению
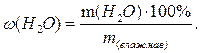
Чаще всего масса определяемого компонента непосредственно не измеряется. В методах осаждения выделяют и взвешивают вещество, либо содержащее, либо химически связанное с определяемым компонентом.
Расчеты результатов гравиметрического анализа базируются на основных стехиометрических законах химии и могут быть проведены по уравнениям реакций. Рассмотрим некоторые расчеты на примерах.
Пример 1. Определение процентного содержания бария в образце, содержащем дигидрат хлорида бария BaCl2·2H2O.
Осаждение иона бария проводят по реакции
BaCl2·H2O + H2SO4 → BaSO4 + 2HCl + 2H2O.
В соответствии с законами стехиометрии, поскольку из одного моля BaCl2·2H2O образуется один моль BaSO4, справедливо следующее соотношение:
в 1 моль (233,4 г) BaSO4 содержится 1 моль (137,3 г) Ва,
в m г BaSO4 содержится x г Ва
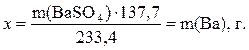
Процентное содержание бария в навеске дигидрата хлорида бария рассчитывают по формуле
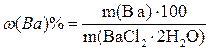 .
.
При проведении большого числа однотипных, серийных анализов для вычислений в гравиметрии используют фактор пересчета F, называемый также гравиметрическим(аналитическим) фактором(аналитическим множителем):
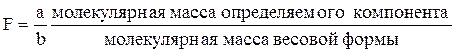 ,
,
где а и b - числа, необходимые для уравнивания числа молей определяемого компонента в числителе и знаменателе.
Зная фактор пересчета, легко рассчитать массу определяемого компонента (mA) в весовой форме (mос):
mA = F·mос
Процентное содержание определяемого компонента в анализируемом веществе можно рассчитать по формуле
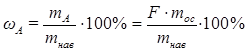 .
.
Например, расчет процентного содержания бария в дигидрате хлорида бария BaCl2·2H2O также можно провести через фактор пересчета:
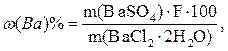
где F – фактор пересчета, равный отношению молярных масс определяемого вещества (Ва) к молярной массе весовой формы BaSO4. В данном случае F=137,3/233,4=0,5883.
Пример 2.Определение массы Fe2O3, которую можно получить из m г Fe3O4.
Превращение Fe3O4 в Fe2O3 осуществляется по схеме
2 Fe3O4 + [O] → 3 Fe2O3.
Отсюда следует, что из каждого моля Fe3O4 получается 3/2 моля Fe2O3.
Число молей Fe2O3 = 3/2 моля Fe3O4
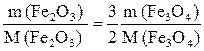 , откуда
, откуда 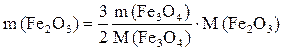 .
.
Преобразуем полученное выражение: 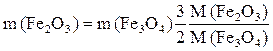 .
.
В данном примере фактор пересчета F равен:
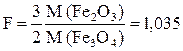 .
.
Список рекомендуемой литературы
Основная
1. Васильев В.П. Аналитическая химия. Кн. 1: Титриметрические и гравиметрический методы анализа. - М.: Дрофа, 2005. - 366 с.
2. Васильев В.П. Аналитическая химия. Лабораторный практикум.- М.: Дрофа, 2004.- 416 с.
3. Васильев В.П. Аналитическая химия. Сборник вопросов, упражнений и задач.- М.: Дрофа, 2004. - 318 с.
4. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. - 559 с.
Дата добавления: 2016-09-20; просмотров: 8398;
