Лекция 35. Расчёт навески. Выбор и расчет осадителя
Ключевые слова: осаждаемая форма, выбор осадителя, расчёт навески и объёма осадителя.
Расчёт и взятие навески анализируемого образца. Допустимая ошибка гравиметрических определений не должна превышать 0,1%. Абсолютная погрешность взвешивания на аналитических весах составляет ± 0,0001 г. С увеличением массы навески относительная погрешность взвешивания уменьшается: отн. погр. = (0,0001/mнавески). Минимальная навеска (с относительной погрешностью ± 0,1%) рассчитывается следующим образом: mнавески = (0,0001г ·100%)/0.1% = 0,1 г. То есть минимальная навеска, которую следует взвешивать на аналитических весах, должна быть не меньше 0,1 г.
При выборе навески анализируемого образца исходят из практической целесообразности и удобства работы с осадками. При расчете навески образца следует учитывать, какую структуру имеет осаждаемая форма. Особенно трудоемкой является обработка аморфных осадков. Поэтому для них навеску рассчитывают исходя из минимального необходимого количества получаемой весовой формы: mосадка ≈ 0,1 г. В зависимости от структуры осадка масса весовой формы может колебаться в следующих интервалах:
аморфный (Fe2О3 ·nH2О) ≈ 0,1 г
кристаллический, легкий (СаСО3) 0,1—0,15 г
кристаллический, тяжелый (BaSО4) 0,2—0,4 г
кристаллический, очень тяжелый (PbSО4) до 0,5 г
Масса кристаллического осадка не должна превышать 0,5 г. Это обеспечивает удобство работы при фильтровании и промывании осадков. Эти примерные критерии служат основанием для оценки массы пробы (навески), необходимой для анализа. Расчёт навески анализируемого вещества осуществляют по уравнению реакции, составляя пропорцию или осуществляя расчет через количество вещества (моль) и молярные массы. Например, при определении бария в хлориде бария навеску вычисляют по уравнению реакции.

Поскольку из 1 моль BaCl2·2H2O образуется 1 моль BaSO4, можно составить пропорцию:
M(BaCl2·2H2O) =244 г/моль ~ M(BaSO4) = 233 г/моль
m(BaCl2·2H2O) ~ m(BaSO4)
Следовательно: m(BaCl2·2H2O)=m(BaSO4)·M(BaCl2·2H2O)/M(BaSO4)≈0,5·244/233≈ 0,5 г.
Можно рассчитывать массу навески образца через количества веществ. По уравнению реакции: n(BaCl2·2H2O) = n(BaSO4) = m(BaSO4)/M(BaSO4);
m(BaCl2·2H2O) = n(BaCl2 ·2H2O)·M(BaCl2·2H2O).
Так как молярная масса хлорида и сульфата бария близкие по величине, расчетная масса навески равна примерно 0,5 г. Учитывая содержание примесей в анализируемом образце, масса навески может быть увеличена до 1 г.
Для аморфных осадков рекомендуемая масса весовой формы равна 0,1г. Например, для анализа содержания железа в нитрате железа (III) проводят цепочку реакций по схеме, в соответствии с которой необходимо учесть соответствующие стехиометрические коэффициенты:
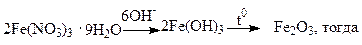
2M(Fe(NO3)3 ·9H2O) ~ M(Fe2O3)
m(Fe(NO3)3 ·9H2O) ~ m(Fe2O3)
m(Fe(NO3)3·9H2O) = [m(Fe2O3)·2M(Fe(NO3)3·9H2O)]/M(Fe2O3) =
= [0,1·2M(Fe(NO3)3·9H2O)]/M(Fe2O3)
Навеску на аналитических весах взвешивают в специальных чистых и сухих стаканчиках – бюксах. Взятие навески можно провести двумя способами.
1-й способ взятия навески. Предварительно на технических, а затем аналитических весах определяют массу пустого бюкса (mпустого бюкса). Затем в бюкс насыпают примерное близкое к рассчитанному количество навески и взвешивают бюкс с навеской сначала на технических, а затем на аналитических весах (m бюкса с навеской). Точную массу навески определяют по разности:
m навески = (m бюкса с навеской - m пустого бюкса).
Взвешенную навеску переносят количественно (без потерь) в химический стакан для приготовления раствора пробы, бюкс тщательно промывают несколько раз небольшими порциями воды (растворителя).
2-й способ взятия навески. Предварительно на технических весах определяют массу пустого бюкса. Затем в бюкс насыпают примерное близкое к рассчитанному количество навески и взвешивают бюкс с навеской сначала на технических, а затем на аналитических весах (m бюкса с навеской). Навеску переносят количественно (без потерь) в химический стакан, бюкс с остатками пробы взвешивают на аналитических весах (m пустого бюкса с остатками). В этом случае бюкс не промывают. Точную массу навески определяют по разности:
m навески = (m бюкса с навеской - m пустого бюкса с остатками).
Требования к осаждаемой форме. В методе осаждения определяемый ион переводят в труднорастворимый осадок - осаждаемую форму, который отфильтровывают, промывают, прокаливают и получают весовую форму. Сульфат бария - BaSO4 - это и осаждаемая и весовая формы. В некоторых анализах после прокаливания получают вещество - весовую форму - отличное по составу от осаждаемой формы. Например, Fe(OH)3 – осаждаемая форма, Fe2O3 –весовая форма.
К осаждаемой форме предъявляются следующие требования:
- малая растворимость; чтобы потери определяемого компонента при анализе составляли не более 0,0001 г, осаждение должно протекать количественно, то есть концентрация оставшегося определяемого компонента в растворе не более 10-6 моль/л;
- по возможности иметь кристаллическую структуру, так как кристаллические осадки меньше загрязняются и легче обрабатываются (промываются, фильтруются);
- легко превращаться в весовую форму при прокаливании.
Эти требования определяют выбор осадителя. Он должен осаждать количественно определяемый компонент в труднорастворимый осадок и быть летучим веществом, чтобы не загрязнять осадок после прокаливания. Например, при определении ионов бария в хлориде бария в качестве осадителя выбирают раствор серной кислоты, а не растворимую соль – сульфат натрия, потому что во время прокаливания (~ 10000C) сульфата бария избыток осадителя – серная кислота разлагается на летучие продукты: воду и оксид серы. Соль - сульфат натрия - адсорбированная на поверхности осадка загрязняет его, так как при прокаливании не разлагается и таким образом увеличивает массу осадка весовой формы.
Расчёт необходимого количества осадителя проводят по уравнению реакции, аналогично описанному выше расчету массы навески анализируемого образца. Рассмотрим на примере определения ионов бария и произведем расчёт по уравнению реакции:

1 моль BaCl2·2H2O взаимодействует с 1 моль H2SO4, составляем пропорцию:
M(BaCl2·2H2O) = 244г/моль ~ M(H2SO4) = 98 г/моль
m навески(BaCl2 2H2O) ~ m(H2SO4)
m(H2SO4) = [m навески(BaCl2·2H2O)·M(H2SO4)]/M(BaCl2·2H2O) = m навески(BaCl2·2H2O)·98/244
Для осаждения необходимо использовать очень разбавленные растворы осадителя. Их готовят разбавлением более концентрированных растворов. Рассчитаем необходимый объем 2 н. (1М) раствора серной кислоты. Если концентрация раствора серной кислоты равна 1 моль/л, в 1000 мл раствора содержится один моль кислоты, то есть 98 г. Составим пропорцию:
В 1000 мл 2 н. раствора ~ 98 г H2SO4
V мл 2 н. раствора ~ m(H2SO4)
Следовательно: V = m(H2SO4)·1000/98= (m навески(BaCl2 ·2H2O)·98/244)·1000/98 =
= m навески(BaCl2·2H2O) ·1000/244 ≈ 4 m навески(BaCl2 ·2H2O).
Для количественного полного осаждения объём осадителя, следует брать в полтора раза больше рассчитанного:
V(изб) =1,5·V = 1,5·4 m навески(BaCl2 ·2H2O) = 6·m навески(BaCl2·2H2O)(мл).
Контрольные вопросы
1. Как рассчитать минимальную массу навески?
2. Какие требования предъявляются к осаждаемой форме?
3. Как выбрать осадитель и рассчитать объём раствора осадителя?
Список рекомендуемой литературы
1.Васильев В.П. Аналитическая химия. Кн. 1. Титриметрические и гравиметрический методы анализа. - М.: Дрофа, 2005. - С.281 - 295.
2. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С.38 - 52.
Л.Е. Салова
Дата добавления: 2016-09-20; просмотров: 11000;
