ПРИНЦИП ЛЕ-ШАТЕЛЬЕ.
Як відзначалося раніше, хімічні рівноваги є динамічними й рухливими. При зміні зовнішніх умов може відбуватися зрушення рівноваги убік утворення або продуктів реакції, або вихідних речовин. Уперше принцип зсуву рівноваги сформулював Ле-Шателье.
Принцип Ле-Шателье: якщо на систему, що перебуває в рівновазі, робити зовнішній вплив, то рівновага зміщається убік того процесу, що зменшує цей вплив.
Теоретично цей принцип був заснований Ф. Брауном і тепер відомий, як принцип Ле-Шателье - Брауна.
Математично цей принцип може бути представлений у вигляді:
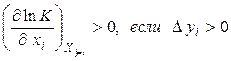 ,
,
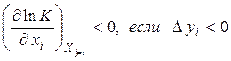 , (11)
, (11)
де  – константа рівноваги, xi– узагальнена сила, yi– узагальнена сполучена даній силі xi координата. Нерівність (4.11) має наступний сенс: зміна узагальненої сили (інтенсивний параметр) при сталості інших сил зміщає рівновага в такому напрямку, при якому зміна сполученої узагальненої координати перешкоджає зміні узагальненої сили. Якщо розглядають вплив температури (узагальненої сили) при сталості інших інтенсивних параметрів на хімічну рівновагу, то як сполучена координата використовують тепловий ефект реакції. Чим більше по величині тепловий ефект реакції, тим сильніше впливає на положення рівноваги зміна температури. При зміні тиску – узагальненої сили – сполученою узагальненою координатою буде зміна об'єму в ході реакції, узяте зі зворотним знаком.
– константа рівноваги, xi– узагальнена сила, yi– узагальнена сполучена даній силі xi координата. Нерівність (4.11) має наступний сенс: зміна узагальненої сили (інтенсивний параметр) при сталості інших сил зміщає рівновага в такому напрямку, при якому зміна сполученої узагальненої координати перешкоджає зміні узагальненої сили. Якщо розглядають вплив температури (узагальненої сили) при сталості інших інтенсивних параметрів на хімічну рівновагу, то як сполучена координата використовують тепловий ефект реакції. Чим більше по величині тепловий ефект реакції, тим сильніше впливає на положення рівноваги зміна температури. При зміні тиску – узагальненої сили – сполученою узагальненою координатою буде зміна об'єму в ході реакції, узяте зі зворотним знаком.
Отже, підвищення (або зниження) температури системи зміщує рівновагу у тому напрямку, у якому поглинається (або виділяється) теплота. Підвищення тиску зміщає рівновага в напрямку зменшення об'єму системи.
Дата добавления: 2016-06-02; просмотров: 727;
