Молекулярно-кинетическая теория идеальных газов
При рассмотрении газообразного вещества часто применяют модель идеального газа, в которой не учитывают:
¾ собственный объем молекул газа по сравнению с объемом резервуара;
¾ пренебрегают энергией взаимодействия молекул;
¾ считают столкновения молекул газа между собой и со стенками сосуда абсолютно упругими.
Для изучения свойств газа его обычно ограничивают сосудом с заданным объемом V. Газ в таком сосуде оказывает давление на стенки р (малые силы отдельных ударов молекул складываются в практически постоянную силу давления на стенку), которое, как показывает опыт, прямо пропорционально концентрации молекул, т. е. их количеству в единице объема и средней кинетической энергии поступательного движения молекул 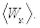 Точный анализ приводит к следующему соотношению
Точный анализ приводит к следующему соотношению
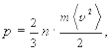 (5.3)
(5.3)
где m ¾ масса молекулы, или
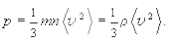 (5.4)
(5.4)
Выражение (5.3) или (5.4) носит название основного уравнения молекулярно-кинетической теории идеального газа. Это уравнение связывает макроскопический параметр (давление) с микроскопическими параметрами молекул газа. В частности мы встречаемся с 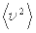 ¾средним значением квадрата скорости молекул. Усреднение необходимо, так как молекулы газа движутся хаотично. Как показывает опыт скорость их движения имеет определенное распределение, установленное Дж. Максвеллом в 1859 году и носящее его имя.
¾средним значением квадрата скорости молекул. Усреднение необходимо, так как молекулы газа движутся хаотично. Как показывает опыт скорость их движения имеет определенное распределение, установленное Дж. Максвеллом в 1859 году и носящее его имя.
Перепишем уравнение (5.2) для средней кинетической энергии поступательного (i = 3) движения молекул в виде
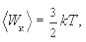 (5.5)
(5.5)
тогда с учетом (5.3) имеем
р = nkT. (5.6)
Так как для смеси идеальных газов n1 + n2 + ... + nn = n, то
р = р1 + р2 + … + рn. (5.7)
В результате получим так называемый закон Дальтона: давление смеси идеальных газов на стенки сосуда равно сумме давлений ее отдельных компонент (парциальных давлений).
Следствием основного уравнения молекулярно-кинетической теории газов (5.4) является уравнение Клапейрона-Менделеева:
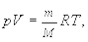 (5.8)
(5.8)
где р ¾ давление газа, m ¾ его масса, V ¾ объем, М ¾ молярная масса, Т ¾ абсолютная температура (К) и R ¾ газовая постоянная.
На основании закона Авогадро можно показать, что один моль любого газа при нормальных условиях (р0 = 1,013 × 105 Па, Т0 = 273,15 К) занимает одинаковый объем Vм =22,41 × 10-3 м3/моль. Таким образом, имеем
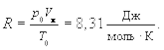
Частными случаями уравнения Клапейрона-Менделеева являются известные законы Бойля-Мариотта, Гей-Люссака и Шарля.
Дата добавления: 2015-10-19; просмотров: 994;
