ГАЛЬВАНІЧНІ ЕЛЕМЕНТИ
І. Загальні поняття про електрохімічні реакції та електродні потенціали
Електрод – це система, яка складається з провідника першого роду, зануреного у електроліт (провідник другого роду). У провідниках першого роду (метали, графіт) електричний струм виникає завдяки руху електронів, у електролітах – завдяки руху іонів, причому електрони не можуть рухатись у електролітах, а іони – у металах. Тому на поверхні розділу фаз відбуваються реакції особливого типу.
Електрохімічні реакції – це процеси обміну електронами між провідниками першого роду та частинками електроліту – іонами та молекулами, які супроводжуються напрямленим рухом електронів.
У металах і графіті в вузлах кристалічної решітки знаходяться катіони, між якими відносно вільно рухаються електрони, причому кількість позитивних зарядів іонів металів дорівнює кількості електронів. Якщо провідник першого роду занурити у електроліт, виникає перерозподіл позитивних та негативних зарядів (іонів, електронів, диполів), причому одна з фаз завжди заряджується позитивно, друга – негативно. Це спричинює виникненню подвійного електричного шару з заряджених частин, що в свою чергу зумовлює появлення стрибка потенціалу, або просто потенціалу.
Розглянемо два випадки цих процесів, звертаючи увагу на те, що у розчинах іони завжди сольватовані та характеризуються певною енергією сольватації – Есольв (для води – енергією гідратації (Егідр). У провідниках першого роду міцність зв’язку між іонами характеризується енергією кристалічної решітки – Екр.
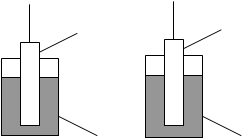
У випадку активних металів (Zn, Fe, Ni) Екр.< Егідр, тому катіони переходять у розчин, гідратуються та групуються біля поверхні розділу фаз, яка заряджується негативно тому, що на неї утворюється надлишок електронів: Ме – nē ® Men+(розч).
 А В
А В
1 2
+ - - + - + + -
+ - - + - + + -
+ - - + - + + -
3 3
Рис.1. А– електрод з активного металу (1), занурений у воду або розчин електроліту з малою концентрацією власних іонів і В – електрод з неактивного металу (2), занурений у розчин з достатньо великою концентрацією іонів металу (3).
У випадку неактивних металів (Cu, Ag) Екр > Егідр, тому катіони не можуть переходити у розчин (точніше, вони переходять у незначних кількостях), але якщо у розчині є іони металів, з яких складається тверда фаза, катіони з розчину починають добудовувати кристалічну решітку і тверда фаза заряджується позитивно внаслідок надлишку катіонів. Біля поверхні розділу групуються аніони з розчину. Сумарний процес буде зміщуватися у бік процесу відновлення: Men+(розч) + nē ® Ме.
У обох випадках утворюється подвійний електричний шар(ПЕШ), який спричинює виникненню стрибка потенціалу. Процес перерозподілу заряджених частинок самовільний, DG < 0. Він йде у електрохімічній системі до досягнення нею стану рівноваги, коли кількість іонів, які переходять у розчин, буде дорівнювати кількості іонів, які осаджуються на поверхні твердої фази (DG0 = 0). Потенціал при DG0 = 0 називається рівноважним і є мірою максимальної роботи того процесу, який самовільно відбувається на електроді.
Будова ПЕШ та величина потенціалу залежить від природи та складу розчину електроліту, природи, стану поверхні електроду та зовнішніх умов.
Електроди можуть бути оборотними та необоротними. Оборотні – це такі електроди, на яких відбуваються оборотні реакції (пряма – самовільна, зворотна – при накладенні протилежно направленої зовнішньої напруги). Наприклад: цинк, занурений у розчин своєї солі:
Zn0 « Zn+2 + 2ē.
Необоротні – це такі електроди, на яких у прямому напрямку відбувається одна реакція, у протилежному (при накладенні зовнішньої напруги) – інша. Наприклад: цинк, занурений у розчин сульфатної кислоти:
пряма реакція Zn0 – 2ē ® Zn+2;
зворотна реакція 2Н+ + 2ē ® Н2.
Безпосереднє вимірювання стрибків потенціалів неможливо, але можливо вимірювати їх різницю між двома електродами, якщо прийняти один електрод за електрод порівняння. Ця характеристика електродної системи називається електродним потенціалом.
2. Основні поняття про гальванічний елемент
Окисно-відновна реакція може відбуватися хімічним шляхом – коли електрони від відновника безпосередньо переходять до окисника. Енергія хімічної реакції в цьому процесі перетворюється на теплову.
Якщо окисно-відновні процеси просторово відокремити, перехід електронів від відновника до окисника спричинює виникнення електричного струму та перетворення хімічної енергії в електричну.
Гальванічним елементом називається пристрій для перетворення хімічної енергії окисно-відновної реакції у електричну енергію.
Він складається з двох електродів, електрохімічно з’єднаних між собою. Вони утворюють електричні кола – зовнішнє та внутрішнє. До зовнішнього кола відносяться електричні проводи та електричні прилади (вимірювачі величини струму та напруги, джерело струму тощо). Внутрішнє коло складається з електродів, причому електроліти з’єднуються між собою напівпроникною мембраною або електролітичним містком, які електрохімічно зв’язують електроліти. Електролітичний місток складається з скляної або пластмасової трубочки, заповненою насиченим розчином КСl і з обох кінців закритою азбестовим гнітом. Через мембрану або електролітичний місток рухаються іони.
У гальванічному елементі, потенціали електродів якого не дорівнюють один одному, процеси на електродах не будуть рівноважними. На одному з них, більш активному, обов’язково йде процес окиснення, на іншому (менш активному) - процес відновлення. Окисна форма речовини (позначається Ох) завжди має більшу алгебраїчну величину заряду, ніж відновна (позначається Red).
Катод - це електрод, на якому відновлюються катіони або нейтральні молекули: Ох + nē ® Red.
 4
4
V
 3
3
1 2
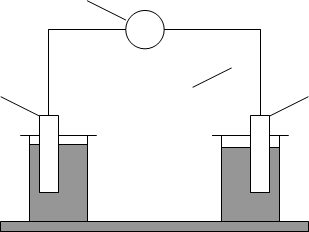
Рис.2. Схема гальванічного елемента (елемент Якобі-Даніеля).
1 - цинковий електрод, занурений у розчин цинк сульфату; 2 - мідний електрод, занурений у розчин купрум сульфату; 3 - електролітичний місток; 4 - вольтметр
 |
2Н+ +2ē ® Н2
Сu2+ + 2ē ® Cu0 - приклади катодних реакцій.
2H2O + 4ē ® H2 + 2ОН-
Анод - це електрод, на якому окиснюються катіони, аніони та нейтральні молекули: Red - nē ® Ox.
 Fe2+ - 1ē ® Fe3+
Fe2+ - 1ē ® Fe3+
4OH- - 4ē ® O2 + 2H2O - приклади анодних реакцій.
Zn0 - 2ē ® Zn2+
Катод – це завжди інертний електрод, на якому є надлишок електронів і які він віддає частинкам електроліту.
Анод може бути інертним (неактивним) або активним. Інертний анод має достатньо велике значення електродного потенціалу (ними можуть бути, як правило, благородні метали та графіт) і тільки приймає на себе електрони від частинок електроліту, тобто служить для їх накопичення. Активний анод сам розчинюється та посилає катіони у розчин, тобто матеріал катоду безпосередньо приймає участь у окисному процесі:
Zn0 -2ē ® Zn2+.
Віднесення електродів до певного типу залежить від значення потенціалів обох електродів: jкат завжди більше, ніж jан. Наприклад, в елементі Якобі-Даніеля анодом буде цинк, а катодом - мідь. Схема цього елемента буде така:
(-)Zn|ZnSO4||CuSO4|Cu (+) або
(-)Zn|Zn2+||Cu2+|Cu (+)
Якщо необхідно, вказують і концентрації електролітів, наприклад:
(-) Zn|ZnSO4, 1 М ||CuSO4, 0,1 М |Cu (+).
Найголовнішою характеристикою гальванічного елементу є його електрорушійна сила - ЕРС (Е), яка дорівнює різниці потенціалів катода та анода, коли вони разомкнуті, тобто, якщо гальванічний елемент знаходиться у оборотному стані.
Е = jкат - jан .
ЕРС завжди позитивна величина, тому що jкат > jан.
3. Термодинаміка гальванічного елемента
Незалежно від того, за яким шляхом, хімічним або електрохімічним, відбувається реакція, енергетичні зміни у системі однакові. З курсу термодинаміки відомо, що максимальна робота виконується системою у рівноважному стані, тобто коли система є оборотною.
Гальванічний елемент є оборотним, якщо виконуються дві умови:
1. він складається з оборотних електродів;
2. до нього підключено зовнішнє джерело електричного струму, ЕРС якого має протилежний напрямок і на нескінченно малу величину відрізняється від ЕРС самого елементу. Прикладом такого елементу є елемент Якобі –Даніеля.
При цих умовах
-DG0 = А макс = nEF,
де n - кількість електронів у сумарній електродній реакції; Е - ЕРС гальванічного елементу, В; F - число Фарадея - кількість електрики, яку переносить один еквівалент електронів; F = ē . NА, Кл/моль.
З другого боку зміна енергії Гіббса пов’язана з константою хімічної рівноваги рівнянням DG0 = – RT . ln K, де K - константа рівноваги відповідної окисної реакції, яка дорівнює добутку рівноважних концентрації продуктів, поділеному на добуток рівноважних концентрацій вихідних речовин з урахуванням стехіометричних коефіцієнтів. Виходячи з цих рівнянь Нернст довів формулу для розрахунку потенціалів електродів в залежності від концентрацій окисної та відновної форм речовини.
Нехай на електроді у загальному вигляді відбувається реакція
aRed - nē « bOx
Для цього процесу рівняння Нернста має вигляд:
j = j0 + RT/nF .ln 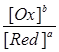 .
.
2,3RT/F = 0,059(2,3– основа натурального логарифму), тому для температу-ри 298 К рівняння можна спростити
j = j0 + 0,059 / n × lg 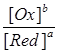 .
.
4. Експериментальне визначення електродних потенціалів
Для визначення електродних потенціалів збирають гальванічний елемент з стандартного водневого електроду і дослідженого електроду.
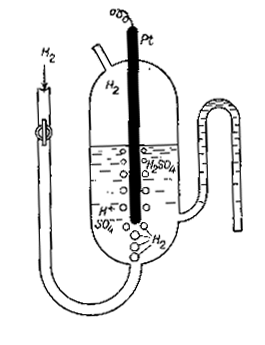 Водневий електрод – це платинова пластина, що покрита губчастою платиною (інертний електрод), яка насичена газоподібним воднем. Він подається під тиском 101,3 кПа у розчин сульфатної або хлоридної кислоти з аН+ = 1моль/л, у який занурена платинова пластина. Схема електроду така: Pt,2H+|H2. (Спочатку вказується матеріал електроду, окиснена і, через риску, відновна форма речовини). На електроді відбуваються пряма або зворотна реакції, в залежності від того, катодом чи анодом буде водневий електрод в парі з дослідженим Рис. 4. Водневий електрод електродом.
Водневий електрод – це платинова пластина, що покрита губчастою платиною (інертний електрод), яка насичена газоподібним воднем. Він подається під тиском 101,3 кПа у розчин сульфатної або хлоридної кислоти з аН+ = 1моль/л, у який занурена платинова пластина. Схема електроду така: Pt,2H+|H2. (Спочатку вказується матеріал електроду, окиснена і, через риску, відновна форма речовини). На електроді відбуваються пряма або зворотна реакції, в залежності від того, катодом чи анодом буде водневий електрод в парі з дослідженим Рис. 4. Водневий електрод електродом.
К: 2Н+ + 2ē ® Н2
А: Н2 - 2ē ® 2Н+.
За тиском водню Р =101,3 кПа і аН+ = 1 моль/л потенціал цього електроду при температурі 298 К умовно прийнято за нульі відносно цього електроду визначаються потенціали усіх інших електродів. Після збирання гальванічного елемента, вимірюють його ЕРС і розраховують потенціал дослідженого електрода.
Наведемо приклади цього визначення. Нехай є електрод, утворений активним металом, який у парі з водневим електродом буде анодом, тобто буде розчинятися. Схема його буде така:
(-) Ме|Меn+||2Н+|Н2, Pt (+).
А: Ме - nē ® Ме n+;
К: 2Н+ + 2ē ® Н20;
ЕРС = j0кат - j0ан = - j0ан.
j0кат = 0, а ЕРС завжди позитивна, тому знак потенціалу аноду повинен бути від’ємним.
Якщо в парі з водневим електродом буде електрод, утворений малоактивним металом, в даному випадку він буде катодом. Схема цього гальванічного елемента така:
(-) Pt, H2|2H+||Men+|Me (+);
А: Н2 -2ē ® 2Н+;
К: Меn+ + nē ® Ме0;
ЕРС = j0кат - j0ан = j0кат.
Отже, електродний потенціалчисельно дорівнює ЕРС гальванічногоелемента, складеного з стандартного водневого електроду та досліджуваного електроду, яка виміряна за стандартних умов. Він позначається j(ел) або Е(ел).
Стандартним електродним потенціалом називається потенціал електрода приактивності іонів у електроліті, які беруть участь у електрохімічній реакції, рівній одиниці. Він позначається j0(ел) або Е0(ел). Наприклад:
j0 (2Н+|Н20 ) = 0,00 В ; j0 (Zn2+|Zn0 ) = -0,76 В.
Всі стандартні потенціали зведені у таблиці, а самі метали утворюють так званий ряд активності металів (або ряд напруг металів). Рядом активності металів називають ряд металів, розміщених у послідовності зростання їх електродних потенціалів. Природно, що у цьому ряду присутній водень, тому що відносно його потенціалу визначаються всі інші потенціали.
Li Ba Ca Na Mg Al Ti Mn Zn Cr Fe Cd Co Ni Sn Pb H2Bi Cu Ag Au
Метали, активніші за водень мають від’ємний знак потенціалу, тому що в парі з водневим електродом є анодами. Малоактивні метали, які розташовані в ряді активності металів після водню, мають додатний знак потенціалу, тому що в парі з водневим електродом грають роль катодів. Наприклад,
j0 (Fe2+|Fe0) = -0,44 В, j0 (Cu2+|Cu0) = +0,34 В.
5. Типи електродів
Електроди, які застосовують у електрохімії залежно від типу оборотності, числа та агрегатного стану фаз, поділяють на кілька груп. Деякі з них ми розглянемо.
Електроди першого роду. До них відносяться розібрані вище метал-іонні електроди. Наприклад, цинковий (Zn2+|Zn), мідний (Cu2+|Cu), залізний (Fe2+|Fe) електроди, у яких метал занурений у розчин власних іонів. Загальна електродна реакція така:
Ме0 – nē « Меn+ .
Рівняння Нернста для них має вигляд:
j (Меn+|Me0 ) = j0 (Men+|Me0 ) + 0,059/n . lg[Me n+]
Потенціал цих електродів за стандартних умов залежить тільки від концентрації катіонів у електроліті. Ці електроди оборотні відносно катіону.
Приклад 1.Розрахувати потенціал залізного електроду, зануреного у 0,1 М розчин ферум (ІІ) хлориду.
Розв’язання:
Для розрахунку потенціалу в таблиці знаходимо значення стандартного потенціалу ( j0(Fe2+|Fe0) = -0,44 В) і використовуємо формулу Нернста:
j(Fe2+|Fe0) = j0(Fe2+|Fe0) + 0,059/2×lg C(Fe2+) = -0,44 + 0,059/2×lg10-1 = -0,44 + (-0,03) = -0,47 В.
Відповідь: потенціал залізного електроду дорівнює -0,47 В.
До електродів першого роду відносяться і неметал-іонні електроди, які оборотні відносно аніону, наприклад, селеновий: Se2–|Se0.
До цього типу електродів відносяться й газові електроди, наприклад, водневий і кисневий (Pt,OH-зO2) електроди. Для виготовлення цих електродів використовують платиновий дротик або пластину, покриті шаром губчастої платини, яка має високу адсорбційну здібність. На поверхні розділу фаз встановлюються рівноважні процеси, які платина каталізує:
2Н+ + 2ē « 2Надс « Н2адс; О2адс + 4ē « 2Оадс; 2Оадс + 2Н2О + 4ē « 4ОН-.
(Надс, Н2адс, О2адс, Оадс - адсорбований атомарний і молекулярний водень і кисень). При РН2= 101,3 кПа та інших значеннях концентрації (активності) водню потенціал водневого електроду розраховується за формулою
j(2Н+½Н2) = -0,059 рН.
Приклад 2. Розрахувати потенціал водневого електроду з концентрацією іонів водню [Н+] = 10-3 М.
Розв’язання:
1. рН - ? рН = - lg[Н+] = -lg10-3 = 3.
2. j(2Н+½Н2) - ? j(2Н+½Н2) = -0,059 рН = -0,059 .3 = -0,0177 В.
Відповідь: при рН = 3 j(2Н+|Н2) = -0,0177 В.
 Електроди другого роду складаються з металу, покритого нерозчинним осадом його сполуки (солі або гідроксиду) і зануреного у розчин, який містить такі ж аніони, як і осад. До них належать, наприклад, каломельний електрод і хлорсрібний електрод.
Електроди другого роду складаються з металу, покритого нерозчинним осадом його сполуки (солі або гідроксиду) і зануреного у розчин, який містить такі ж аніони, як і осад. До них належать, наприклад, каломельний електрод і хлорсрібний електрод.
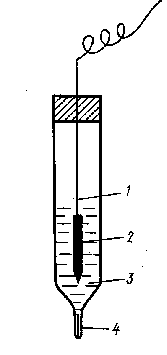
Хлорсрібний електрод складається з срібного дротика, покритого шаром хлориду срібла, який занурено у розчин хлориду калію. Електролітичний контакт з зовнішнім розчином відбувається крізь гніт з азбесту.
Рис.4. Хлорсрібний електрод
1– срібний провідник, 2 –шар AgCl, 3 – розчин КСІ,
4 – отвір для з’єднання з розчином, закритий азбестом
Схема хлорсрібного електрода: Ag,AgCl|KCl. Він оборотний відносно аніону Сl– згідно з реакціями : Ag+ + e « Ag0 та AgCl + e « Ag + Cl–.
Потенціал хлорсрібного електроду визначається за формулою
jхс = j0хс – 0,059 lg[Сl–].
Його величина залежіть від концентрації (активності) хлорид-іонів. Звичайно використовують дві концентрації солі КСl 0,1 моль/л та 1,0 моль/л, при яких потенціал відповідно дорівнює 0,29 В і 0,238 В.
Електроди другого роду використовують як електроди порівняння, замість не дуже зручного водневого електроду. Вони відрізняються простотою виготовлення та зручністю використання.
До окисно-відновних електродів (або редокс-електродів), належать напівелементи, які складаються з інертного металу (платина, золото), зануреного у розчин, в якому містяться окиснена та відновна форма однієї й тієї ж речовини. Наприклад:
Pt, Fe3+зFe2+ ; Fe3+ + ē ® Fe2+
Pt, МnO4- + 8H+ зMn2+ + 4H2O ; MnO4- + 8H+ + 5ē ® Mn2+ + 4H2O
Атоми платини не беруть участь у електродному процесі, а є тільки переносниками електронів. Величина електродного потенціалу залежить від концентрацій окисної та відновної форм речовини
j (Oх зRed) = j0(Oх зRed) +  lg
lg 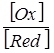
Наприклад, j (Fe3+зFe2+) = j0 (Fe3+зFe2+) + 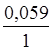 lg
lg 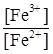 ;
;
j(МnO4-+8H+зMn2++4H2O) =
j0(МnO4-+8H+зMn2++4H2O) + 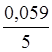 lg
lg 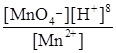
Cтандартні окисно-відновні потенціали зведені у таблиці й також визначаються за водневою шкалою, тобто порівнюються з потенціалом стандартного водневого електрода. Вони характеризують здатність системи функцінувати в якості окисника або відновника. Чим більш позитивне значення ОВ потенціалу, тим сильнішим окисником є система. Знак (-) означає, що самовільно відбувається процес відновлення, знак (+) - процес окиснення. Наприклад:
електрод електродні процеси j, В самовільний процес
Pt,Cr3+|Cr2+ Cr3+ + 1ē « Cr+2+ -0,41 Cr2+ - 1ē ® Cr3+;
Pt,Sn4+|Sn+2+ Sn4+ + 2ē « Sn2+ +0,15 Sn4+ + 2ē ® Sn2+.
Приклад 3. Розрахувати потенціал окисно-відновного манганового електрода, якщо концентрації перманганат-іона та іона Mn+2 дорівнюють одиниці, а рН розчину дорівнює трьом.
Розв’язання:
1.j(МnO4-+8H+зMn2++4H2O) -?
Використовуємо значення стандартного потенціалу, взятого з таблиць і рівняння Нернста для окисно-відновних електродів.
j0(МnO4-+8H+зMn2++4H2O) = 1,55 В.
j(МnO4-+8H+зMn2++4H2O) = j0(МnO4-+8H+зMn2++4H2O) + + 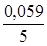 lg
lg 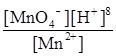 = 1,55 +
= 1,55 + 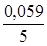 lg
lg 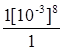 = 1,55 +
= 1,55 + 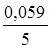 lg 10|–24 = 1,55 - 0,28 = 1,27 В.
lg 10|–24 = 1,55 - 0,28 = 1,27 В.
Відповідь: Потенціал манганового електроду у розчині з рН 3 дорівнює 1,27 В.
Використання розрахунку ЕРС для окисно-відновних елементів дає можливість визначити напрямок окисно-відновної реакції незалежно від того, хімічним, або електрохімічним шляхом вона йде. Ввжається, що відновна реакція відповідає анодному процесу, а реакція окиснення - катодному. Тоді
ЕРС = jкат - jан = jокис - jвід > 0. Приклад наведений в темі «Окисно-відновні реакції».
6. Типи гальванічних елементів та їх розрахунки
Гальванічні елементи поділяють на хімічні та концентраційні. У хімічних елементах рушійною силою процесу та джерелом електричної енергії є хімічна реакція. Їх ЕРС залежить від хімічної природи речовин і їх активностей у розчині. Прикладами хімічних кіл є системи з електродів першого і другого роду, акумулятори, окисно-відновні елементи.
Концентраційні елементи складаються з електродів однакової хімічної природи, які відрізняються один від другого лише концентрацією розчинів. Рушійною силою процесу та джерелом електричної енергії є вирівнювання концентрацій речовин у електролітах обох електродів, яке відбувається електрохімічним шляхом, а не за рахунок дифузії. Як тільки концентрації іонів у електролітах стануть дорівнювати одна одній, гальванічний елемент перестає діяти, тому що його ЕРС = 0. На електродах відбувається одна й та ж реакція, але у різних напрямках, тобто відбувається перенос речовини з одного електрода на другий:
Прикладом може бути такий елемент
(-) Ag |AgNO3,С1 ||AgNO3 , С2|Ag (+); С1 < С2 .
На першому електроді - аноді, де концентрація електроліту нижче, метал розчинюється, його катіони переходять у розчин. На другому електроді - катоді, де концентрація електроліту вище, катіони металу будуть осаджуватися
А: Ag0 - 1ē ® Ag+, С1;
К: Ag+ +1ē ® Ag0 , С2.
Сумарна реакція має вигляд : Ag0 - 1ē « Ag+
ЕРС = jкат - jан = j0 + 0,059 lg С2 - j0 - 0,059 lg С1 = 0,059lg(С2/С1).
Загалом, формула для розрахунку ЕРС у концентраційних колах має вигляд:
Е = 0,059/n × lg(С2/С1).
Для розрахунку гальванічних елементів необхідно:
1. Розрахувати значення потенціалів обох електродів;
2. Визначити катод і анод;
3. Записати схему гальванічного елемента та указати напрямок електричного струму;
4. Записати електродні процеси;
5. Розрахувати ЕРС елемента;
6. Розрахувати DG0 та Амакс.
Приклад 4. Розрахувати гальванічний елемент, складений з цинкової пластини, зануреної у розчин цинк сульфату з концентрацією 10-3 моль/л та залізної пластини, зануреної у розчин ферум хлориду з концентрацією 10-1 моль/л.
Розв’язання:
1. j(Zn2+|Zn), j(Fe2+|Fe) - ?
В таблиці стандартних потенціалів знайдемо значення стандартних електродних потенціалів систем Zn2+|Zn0 та Fe2+|Fe0 і розрахуємо потенціали окремих електродів за рівнянням Нернста.
j0(Zn2+|Zn0) == -0,76 B, j0(Fe2+|Fe0) = -0,44 B.
j(Zn2+|Zn0) = j0(Zn2+|Zn0) + (0,059/2) × lg С(Zn2+) = -0,76 + (0,059/2) × lg10-3 = = -0,76 + (-0,09) = -0,85 В.
j(Fe2+|Fe0) = j0(Fe2+|Fe0) + (0,059/2 ) × lg С(Fe2+) = - 0,44 + (0,059/2) × lg0,1 = = -0,44 + 0,03 (-1) = -0,47 В.
2.Визначення катода та анода.


 -0,85 В -0,47 В
-0,85 В -0,47 В
А К
Цинковий електрод буде анодом, оскільки має більш від’ємний потенціал, залізний електрод буде катодом (більша алгебраїчна величина потенціалу).
 3. Схема гальванічного елемента та напрямок електричного струму.
3. Схема гальванічного елемента та напрямок електричного струму.

 (-) Zn |Zn(NO3)2 (10-3 М) || Fe(NO3)2 (0,1 М )| Fe (+).
(-) Zn |Zn(NO3)2 (10-3 М) || Fe(NO3)2 (0,1 М )| Fe (+).
4. Електродні процеси.
А: Zn0 - 2ē ® Zn2+;
на цинковому електроді відбувається процес окиснення цинка.
К: Fe2+ + 2ē ® Fe0;
на залізному електроді відбувається відновлення заліза.
5. ЕРС - ?
Е = j(Fe2+|Fe0) - j(Zn2+|Zn0), = -0,47 – (-0,85) = 0,38 В.
6. DG0 -?
DG0 = -nEF = -2×0,38 ×96500 = –73340 Дж/моль.
Відповідь: ЕРС елементу дорівнює 0,38 В, DG0 = -73340 Дж/моль.
Питання та задачі
1. Що називається електродом? Які реакції відбуваються на ньому?
2. Що трапиться, якщо активний або неактивний метал занурити у розчин власної солі?
3. Дати визначення поняттям “потенціал” і “стандартний потенціал”? Як вони експериментально вимірюються та розраховуються?
4. Дати схему та пояснити дію водневого електрода.
5. Які типи електродів ви знаєте?
6. Яка формула встановлює залежність значення електродного потенціалу від концентрації електроліту?
7. Дайте визначення поняттю “гальванічний елемент”. З чого він складається?
8. Охарактеризуйте катоди та аноди в гальванічному елементі.
9. Наведіть умови оборотності гальванічного елемента. При якому стані його виконуються умови -DG0 = Амакс = nEF?
10. Що таке ЕРС гальванічного елемента та за якою формулою розраховується ця характеристика?
11. Які типи гальванічних елементів ви знаєте? Чим вони відрізняються?
12. Скласти схеми гальванічних елементів, в одному з яких мідь була б анодом, а у другому - катодом. Написати рівняння реакцій, які відбуваються на електродах при роботі цих гальванічних елементів та розрахуйте ЕРС, використавши стандартні значення потенціалів.
13. Гальванічний елемент складається з срібного електрода, зануреного у 1 M розчин AgNО3, та стандартного водневого електрода. Визначити його ЕРС. Написати електродні та сумарну реакції, які відбуваються у гальванічному елементі.
14. Напишіть схему концентраційного гальванічного елемента, складеного з цинкових електродів. Концентрація іонів цинку у розчинах дорівнює відповідно 0,1 та 0,5 моль/л. Розрахувати ЕРС та максимально корисну роботу, яку виконує цей гальванічний елемент.
15. У якому напрямку будуть рухатись електрони у зовнішньому колі наступних гальванічних елементів: а) Mg|Mg2+||Pd2+|Pb; б) Pb|Pb2+||Cu2+|Cu; в) Cu|Cu2+||Ag+|Ag, якщо всі розчини електролітів одномолярні? Розрахуйте ЕРС цих елементів.
Дата добавления: 2015-09-18; просмотров: 10116;
