Практическое занятие 8: Стандартные электродные потенциалы, уравнение Нернста. Коррозия.
Цель занятия: Формирование необходимого комплекса знаний об электрохимических процессах и их количественных характеристиках. Формирование навыков использования фундаментальных законов и основных понятий химической науки в области электрохимии для понимания характеристик процессов, используемых в современной промышленности и в быту.
Требования к знаниям, которые студент должен приобрести в результате освоения темы:
знать:основные положения теории электрохимических процессов (гальванический элемент, коррозия)
уметь: составлять уравнения процессов, протекающих при работе гальванического элемента, коррозии, рассчитывать их количественные характеристики.
Теоретическая часть:
Окислительно-восстановительные процессы, сопровождающиеся взаимными превращениями электрической и химической энергии, называются электрохимическими. Раздел химии, в котором изучаются химические процессы, протекающие с поглощением или выделением электрической энергии, называется электрохимией.
Процессы перехода химической энергии в электрическую характерны для химических источников электрической энергии, к которым относятся гальванические элементы, аккумуляторы, топливные элементы. Превращение химической энергии в электрическую широко используется в энергетике.
Электрохимические реакции протекают на границе раздела фаз металл (электрод) | раствор электролита, металл | металл, электролит | электролит. Поскольку протекание электрохимического процесса сопряжено с обменом заряженными частицами между двумя фазами, то у фаз, участвующих в обмене, возникают электрические заряды и, как следствие, – скачок электрического потенциала на границе раздела фаз.
Скачок потенциала на границе раздела фаз электрод | электролит называется электродным потенциалом (φэ).
При взаимодействии металла с водным раствором его соли (рис.4) полярные молекулы воды, взаимодействуя с катионами металлической решетки на ее поверхности, облегчают переход ионов в раствор и поэтому на границе раздела металл | раствор возможна следующая реакция (реакция окисления):
M +mН2О → Mn+ ·mН2О + ne-,
где М – металл,
Mn+· mН2О – гидратированный катион металла.
 Без учета гидратации ионов процесс имеет вид:
Без учета гидратации ионов процесс имеет вид:
M → Mn+ + ne-
В результате поверхность металла заряжается отрицательно, а слой электролита около него – положительно. На границе раздела фаз формируется двойной электрический слой (ДЭС). Такой процесс возможен при погружении цинкового электрода в раствор соли цинка (например – в сульфат цинка). Металл заряжается отрицательно только в том случае, когда энергия его кристаллической решетки меньше энергии сольватации.
Если кристаллическая решетка металла прочна (Екрист. реш. > Есольв.), происходит обратный процесс – осаждение металла из раствора, сопровождающееся потерей гидратной оболочки катионами металла (реакция восстановления):
Mn+ ·mН2О + ne-→ M +mН2О
Mn+ + ne-→ M
Примером такого процесса является пара электрод | электролит, состоящая из медного электрода, погруженного в раствор сульфата меди.
Переход зарядов через границу раздела фаз электрод | электролит в том или ином направлении происходит в зависимости от того, в какой из фаз – в металле или электролите – ионы обладают большим электрохимическим потенциалом. В общем случае возможность протекания реакции на границе раздела фаз в определенном направлении обусловлена разностью химических потенциалов реагирующих частиц в этих фазах.
Процесс обмена приведет к образованию на границе металл | электролит ДЭС, т.е. к разделению электрических зарядов. ДЭС можно сравнить с конденсатором, одна из обкладок которого представляет собой поверхность металла, а другая – слой ионов в растворе у поверхности металла. Между разноименными обкладками возникает скачок потенциала. Скачок потенциала на границе раздела фаз электрод | электролит называется электродным потенциалом (φэ).
|
При разделении растворов электролита с разными концентрациями полупроницаемой мембраной на границе раздела электролит | электролит также образуется ДЭС. Этот процесс будет обусловлен переходом ионов с размерами, меньшими, чем отверстия мембраны, из области с большей концентрацией в область с меньшей концентрацией. Скачок потенциала в этом случае называют диффузионным потенциалом (φд).
Примером использования электрохимического процесса, в результате которого химическая энергия превращается в электрическую, является гальванический элемент (рис. 6). Электродвижущая сила такого элемента представляет собой разность равновесных потенциалов положительного и отрицательного  электродов. Относительные электродные потенциалы определяются при помощи стандартного водородного электрода. Эти потенциалы определяются при условии отсутствия в цепи электрического тока. При прохождении тока потенциалы изменяются; этот процесс называется поляризацией. Различают концентрационную и электрохимическую поляризацию.
электродов. Относительные электродные потенциалы определяются при помощи стандартного водородного электрода. Эти потенциалы определяются при условии отсутствия в цепи электрического тока. При прохождении тока потенциалы изменяются; этот процесс называется поляризацией. Различают концентрационную и электрохимическую поляризацию.
Схему приведенного на рис. 6 гальванического элемента, состоящего из медного и цинкового электродов, погруженных в растворы их солей, можно записать следующим образом:
(–) Zn | Zn2+ || Cu2+ | Cu (+)
Этот элемент называется гальваническим элементом Даниэля – Якоби. Принцип записи схемы заключается в следующем: слева записывается анод Zn | Zn2+, на котором возникает избыток электронов и происходит процесс окисления – отрицательный полюс или анод (–). Справа записывается катод Cu2+ | Cu – электрод с недостатком электронов, т.е. положительный полюс (+). Одинарная вертикальная линия изображает границу раздела фаз между электродом (металлом) и раствором электролита. Двойная вертикальная линия отделяет анодное пространство от катодного.
Для характеристики работы гальванического элемента используется разность потенциалов катода и анода, которая должна быть положительной. Значения электродных потенциалов зависят от природы электродов, природы и среды (рН) электролитов, концентрации электролитов и температуры. Зависимость потенциала от условий внешней среды выражается уравнением Нернста:
φ = φ0 + 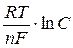
где φ – электродный потенциал металла при заданных условиях, В;
φ0 – стандартный электродный потенциал металла, В;
R – универсальная газовая постоянная, R = 8,3144 Дж/(моль∙K);
T – абсолютная темперетура, К;
n – число электронов, принимающих участие в электродной реакции;
F – постоянная Фарадея, F = 96485,309 Кл/моль (F ≈ 96500 Кл/моль);
C – молярная концентрация ионов металла в растворе электролита, моль/л.
Используя значение температуры, соответствующее стандартным условиям, Т = 298,15 К, численные значения используемых в уравнении Нернста констант и выполнив переход от натурального логарифма (ln) к десятичному (lg), получим уравнение Нернста в виде:
φ = φ0 + 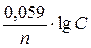
Основной характеристикой электрода является стандартный электродный потенциал – потенциал, возникающий на границе раздела электрод | электролит, определяемый при стандартных условиях относительно выбранного электрода сравнения. Стандартный потенциал находят при следующих условиях:
Ø металл находится в растворе своей соли;
Ø молярная концентрация ионов металла в растворе электролита составляет 1 моль/л;
Ø измерения производят при температуре 25 0С (298 К);
Ø для газовых электродов давление газа равно 1,01 • 105 Па (1 атм).
Для водных растворов в качестве стандартного электрода используют водородный электрод, потенциал которого при всех температурах принимается равным нулю. Водородный электрод сравнения (рис. 7) состоит из стеклянной емкости, в которую впаивается платиновый электрод, покрытый мелкодисперсной платиной (платиновой чернью). Электрод погружен в раствор кислоты с активностью ионов водорода 1 моль/л и обдувается газообразным водородом, который адсорбируется платиновой чернью. Между водородом, адсорбированным платиновой чернью, и ионами водорода в растворе устанавливается рав  новесие. Измерение относительного потенциала любого электрода производят, составляя электрохимическую цепь, включающую исследуемый и водородный электроды, причем водородный электрод может быть как катодом, так и анодом. Полученные относительно водородного электрода значения стандартных электродных потенциалов, расположенные в порядке их возрастания образуют ряд стандартных электродных потенциалов (ряд напряжений) металлов (приложение 8). В химической практике широко используются следствия, вытекающие из ряда напряжений металлов:
новесие. Измерение относительного потенциала любого электрода производят, составляя электрохимическую цепь, включающую исследуемый и водородный электроды, причем водородный электрод может быть как катодом, так и анодом. Полученные относительно водородного электрода значения стандартных электродных потенциалов, расположенные в порядке их возрастания образуют ряд стандартных электродных потенциалов (ряд напряжений) металлов (приложение 8). В химической практике широко используются следствия, вытекающие из ряда напряжений металлов:
Ø чем левее расположен металл в ряду напряжений, тем выше его восстановительные свойства;
Ø чем правее расположен металл в ряду напряжений, тем выше его окислительные свойства;
Ø каждый металл способен вытеснять из растворов солей все другие металлы, стоящие в ряду напряжений правее него;
Ø все металлы, расположенные в ряду напряжений левее водорода, способны вытеснять его из кислот;
Ø чем дальше в ряду напряжений расположены друг от друга два металла, тем большее напряжение будет давать построенный из них гальванический элемент.
Устройства, используемые для непосредственного преобразования энергии химического процесса в электрическую энергию, называют химическими источниками тока. Такие источники широко применяются в различных областях техники: в средствах связи, в электроизмерительной аппаратуре, в качестве источников электропитания транспортных средств и др. Химические источники тока представлены двумя типами: обратимые и необратимые. Обратимые химические источники тока – аккумуляторы – используются многократно, поскольку их работоспособность восстанавливается при пропускании тока в обратном направлении от внешнего источника. Основными характеристиками аккумуляторов являются КПД, ЭДС, механическая прочность, срок службы. Эти характеристики зависят от используемых при изготовлении аккумулятора материалов.
 Необратимые химические источники тока – гальванические элементы – предполагают однократное использование, так как один из электродов необратимо расходуется. К характеристикам гальванических элементов относятся ЭДС, напряжение, мощность, емкость, энергия.
Необратимые химические источники тока – гальванические элементы – предполагают однократное использование, так как один из электродов необратимо расходуется. К характеристикам гальванических элементов относятся ЭДС, напряжение, мощность, емкость, энергия.
Важную роль в группе химических источников тока играют топливные элементы – устройства, преобразующие химическую энергию топлива (водорода) в электрическую в процессе электрохимической реакции напрямую, в отличие от традиционных технологий, при которых используется сжигание твердого, жидкого и газообразного топлива. В топливном элементе (рис. 8) для производства электрической энергии используется топливо, подаваемое от внешнего источника. В качестве окислителя в топливных элементах применяется кислород, топливом является водород. В топливном элементе в общем виде протекает токообразующая реакция, в результате которой в цепи генерируется постоянный ток, и химическая энергия непосредственно превращается в электрическую:
2H2 + O2 → 2H2O + электричество + тепло.
Характеристиками топливных элементов являются ЭДС, напряжение, мощность и КПД.
Для производства электрической энергии может использоваться не только чистый водород, но и другое водородосодержащее сырье, например, природный газ, аммиак, метанол или бензин. В качестве источника кислорода, также необходимого для реакции, используется обычный воздух. Если в качестве топлива выступает водородосодержащее сырье, например, природный газ, побочными продуктами реакции будут и другие газы, например, оксиды углерода и азота, но в количестве гораздо меньшем, чем при прямом сжигании природного газа.
Важное место в электрохимических исследованиях занимает исследование процессов коррозии, поскольку стойкость и надежность конструкционных материалов и разработка методов их защиты определяют, в конечном итоге, эффективность большинства технологий, используемых в промышленности.
Под коррозией (от лат. corrosio – разъедание) понимают самопроизвольное разрушение металлов (и их сплавов) в результате химического и электрохимического взаимодействия с окружающей средой. По механизму взаимодействия металлов с внешней средой различают химическую и электрохимическую коррозию. Химическая коррозия характерна для сред, не проводящих электрический ток: сухих (содержание влаги не более 0,1 %) газов при высокой температуре (HClг, Cl2, SO2, H2S, NOx и др.) – газовая коррозия; газообразных компонентов воздуха (O2, CO2, пары воды) или любого влажного газа – атмосферная коррозия; коррозия в жидких неэлектролитах (нефтепродукты, растворы сахара, спирты и др.). В процессе химической коррозии происходит прямое взаимодействие металла, выступающего в роли восстановителя, с окружающей, не электропроводящей, средой (окислитель):
4Fe + 3O2 → 2Fe2O3;
2Al + 3Cl2 → 2AlCl3
2R–Cl + Me → MeCl2 + R–R
где R – органический радикал.
Электрохимическая коррозия возникает при взаимодействии металлов с растворами электролитов (коррозионной средой), в результате чего образуются локальные гальванические элементы. Электрохимическая коррозия является наиболее распространенным типом коррозии и сопровождается химическими реакциями и переносом электрических зарядов между металлом и окружающей средой при участии воды. При этом взаимодействие металла с окружающей средой протекает на отдельных участках поверхности металла и характеризуется анодным и катодным процессами. Разрушение металла происходит только на анодных участках. Скорость коррозии определяется величиной электродного потенциала металла, состоянием его поверхности, температурой и рН раствора.
Процесс коррозии является анодным растворением металла под влиянием катодного восстановления окислителя. Наиболее распространенными окислителями в коррозионных процессах являются ионы водорода и молекулы кислорода. Коррозия с участием ионов водорода называется коррозией с водородной деполяризацией (выделение водорода) и при ее протекании происходят следующие процессы:
Анод: Meo – nē → Men+ (окисление)
Катод (в кислой среде): 2Н+ + 2ē →Н20↑ (восстановление)
Катод (в щелочной среде): Н2О + 2ē = Н2↑ + 2ОН− (восстановление)
Коррозия с участием растворенного в электролите кислорода называется коррозией с кислородной деполяризацией (поглощение кислорода):
Анод: Meo – nē → Men+ (окисление)
Катод: О2 + 2Н2О + 4ē → 4ОН– (восстановление)
Скорость такой коррозии зависит от природы металла (потенциал кислородного электрода положительнее потенциала металла), от концентрации кислорода в растворе, скорости диффузии кислорода. На скорость коррозии с водородной и кислородной деполяризацией влияет образование на поверхности металла защитных оксидных пленок. К таким металлам относятся алюминий, титан, хром, никель, свинец и др. Замедление или прекращение процессов коррозии называется пассивацией металла.
Значимыми в промышленных масштабах разновидностями электрохимической коррозии являются почвенная коррозия и электрокоррозия. Почвенная (грунтовая) коррозия представляет собой разрушение подземных металлических сооружений под воздействием почвенного электролита и является причиной разрушения таких строительных сооружений как сваи, опоры, подземные трубопроводы. Электрокоррозия или коррозия блуждающими токами – это процесс разрушения протяженных подземных металлических сооружений, вызванный действием проникающих блуждающих токов (токи, ответвляющиеся от своего пути) различных электроустановок. Источниками блуждающих токов чаще всего являются рельсовые пути, сварочные агрегаты и др.
Коррозия является процессом, приносящим немалые убытки сооружениям и оборудованию, используемому в различных отраслях производства. Поэтому одно из главных направлений научных исследований в данной области – защита материалов от коррозии. Коррозию можно затормозить изменением потенциала металла, снижением концентрации окислителя, изменением состава сплава и т.д.
К основным методам защиты от коррозии относятся:
Ø легирование металлов (сплавов), то есть введение в их состав компонентов (хром, никель, кремний, молибден, вольфрам, магний), образующих на поверхности плотные защитные оксидные слои. Легирование используется для повышения коррозионной стойкости металлов, работающих в агрессивных средах при высоких температурах;
Ø изменение свойств коррозионной среды, как правило, с помощью ингибиторов коррозии или при изменении рН среды;
Ø защитные металлические и неметаллические покрытия. По способу действия металлические покрытия разделяют на катодные и анодные. Катодные покрытия предполагают использование менее активного металла для защиты более активного. Примером такого покрытия является луженое (покрытое оловом) железо. Отличительной особенность анодного покрытия является защита менее активного металла более активным, например, использование цинка для защиты железа (оцинкованное железо.) В качестве неметаллических покрытий используют полимерные материалы, лаки, краски, эмали, резины и т.п.
Ø электрохимическая защита предполагает либо использование протектора (присоединение к защищаемой конструкции более активного металла), либо защиту внешним током;
Ø рациональное конструирование и эксплуатация изделий.
Практическая часть (примеры решения задач):
Задача 1: Рассчитайте электродный потенциал железа, погруженного в раствор FeSO4, если концентрация соли равна 0,01 моль/л.
Решение: Поскольку заданная концентрация электролита отличается от стандартной, а другие условия протекания процесса взаимодействия электрод/электролит не указаны, необходимо воспользоваться уравнением Нернста в виде:
φ = φ0 + 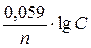
Стандартный электродный потенциал железа на основании справочных данных (приложение 8) φ0 = –0,44 В. Электродная реакция имеет вид:
Fe2+ + 2ē ⇄ Fe0
поэтому в процессе участвуют 2 электрона (n = 2)
Поэтому
φ = –0,44 + 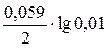 = –0,499 В
= –0,499 В
Задача 2: Рассчитайте ЭДС и составьте схему гальванического элемента, электродами для которого являются пластинки из олова и свинца в стандартных условиях. Что изменится в схеме гальванического элемента, если концентрация ионов свинца в растворе составит 0,001 моль/л, а олово останется в стандартных условиях? Составьте схему нового гальванического элемента.
Решение: Разделим решение задачи на 2 части.
Часть 1: Для составления схемы гальванического элемента воспользуемся справочными данными о стандартных электродных потенциалах (приложение 8):
φ0(Sn2+/Sn) = –0,14 В.
φ0(Pb2+/Pb) = –0,13 В.
Поскольку окислительно-восстановительная реакция, характеризующая работу гальванического элемента, протекает в направлении, где ЭДС элемента принимает положительное значение, определим значение ЭДС. Так как олово имеет меньший потенциал, оно будет являться анодом, на котором протекает процесс окисления (анодный процесс):
Sn0 – 2ē ⇄ Sn2+
Свинец, потенциал которого больше, будет выполнять роль катода и участвовать в восстановительном процессе (катодный процесс):
Pb2+ + 2ē ⇄ Pb0
Сложение катодного и анодного процесса даст нам уравнение окислительно-восстановительной реакции, характеризующей работу данного гальванического элемента:
Sn0 + Pb2+ ⇄ Sn2+ + Pb0
Значение ЭДС этого элемента:
ЭДС = φк – φа = –0,13 – ( –0,14) = 0,01 В
Следовательно, схема гальванического элемента будет иметь вид:
(–) Sn | Sn2+ || Pb2+ | Pb (+)
Часть 2: Для того чтобы определить, что изменится в схеме гальванического элемента, если концентрация ионов свинца в растворе составит 0,001 моль/л, рассчитаем электродный потенциал свинца в заданных условиях по уравнению Нернста по аналогии с задачей 1:
φ׳(Pb2+/Pb) = –0,13 + 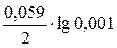 = –0,2185 В
= –0,2185 В
В данном случае, произошло изменение соотношений потенциалов. Теперь свинец имеет меньший потенциал и будет являться анодом, а олово, потенциал которого больше – катодом. Процессы будут иметь вид:
анодный процесс: Pb0 – 2ē ⇄ Pb2+ (окисление)
катодный процесс: Sn2+ + 2ē ⇄ Sn0 (восстановление)
ЭДС полученного элемента:
ЭДС = φк – φа = –0,14 – ( –0,2185) = 0,0785 В
Следовательно, схема нового гальванического элемента примет вид:
(–) Pb | Pb2+ || Sn2+ | Sn (+)
Задача 3: Как происходит атмосферная коррозия луженого железа и луженой меди? Приведите уравнения процессов; укажите продукты каждой реакции.
Решение: Для решения поставленной задачи воспользуемся справочными данными о стандартных электродных потенциалах, не забывая о том, что термин «луженый» говорит об использовании олова в качестве защитного покрытия:
φ0(Fe2+/Fe) = –0,44 В.
φ0(Cu2+/Cu) = +0,34 В.
φ0(Sn2+/Sn) = –0,14 В.
В паре железо – олово при нарушении защитного покрытия железо, имеющее меньший электродный потенциал, будет являться анодом, а олово – катодом. Поэтому оловянное покрытие на железе является катодным покрытием. Ионы железа будут переходить в раствор (анод, процесс окисления):
Fe0 – 2ē ⇄ Fe2+
Так как в воздухе присутствуют водяные поры, конденсирующие на поверхности металла кислород, на катоде пойдет реакция восстановления кислорода:
О2 + 2Н2О + 4ē → 4ОН–
Суммарное уравнение коррозионного процесса с учетом числа принятых и отданных электронов:
2Fe + O2 + 2H2O → 2Fe(OH)2
В результате вторичных процессов на железе образуется ржавчина:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
В паре медь – олово при нарушении защитного покрытия олово, имеющее меньший электродный потенциал, будет являться анодом, а медь – катодом. Поэтому оловянное покрытие на меди является анодным покрытием. Оловянное покрытие на меди считается одним из наиболее эффективных, и по ряду данных продлевает срок службы изделий более чем на 100 лет. Но при нарушении целостности покрытия будут протекать следующие процессы:
Анод: Sn – 2ē → Sn2+ ;
Катод: 2H2О + O2 + 4ē → 4OH-
Суммарное уравнение коррозионного процесса с учетом числа принятых и отданных электронов:
2 Sn + 2H2О + O2 → 2Sn(OH)2
Контрольные вопросы:
1. Какие процессы называются электрохимическими?
2. Какова область приложения электрохимических процессов?
3. Каков механизм протекания электрохимических процессов?
4. Как образуется ДЭС при протекании электрохимического процесса? Приведите примеры для различных фазовых разделов.
5. Как возникают электродные потенциалы?
6. Объясните принцип работы гальванического элемента.
7. Какая величина называется стандартным электродным потенциалом? Как она определяется?
8. Приведите примеры химических источников тока, определите области их применения, проанализируйте достоинства и недостатки.
9. Что называют коррозией металлов?
10. Как классифицируют процессы коррозии?
11. В чем отличие электрохимической коррозии от химической? Приведите примеры.
12. Какие факторы влияют на скорость коррозии?
13. Охарактеризуйте основные методы борьбы с коррозией металлов.
Контрольные задания:
1. Рассчитайте электродный потенциал олова, погруженного в раствор его нитрата с концентрацией соли 0,0001 М.
2. Рассчитайте ЭДС и составьте схему гальванического элемента, электродами для которого являются пластинки из магния и цинка в стандартных условиях.
3. Что изменится в схеме гальванического элемента, приведенного в задании 2, если концентрация ионов магния в растворе составит 0,01 моль/л, а другой элемент останется в стандартных условиях? Составьте схему нового гальванического элемента.
4. Железное изделие покрыли свинцом и кадмием. Укажите тип покрытия в каждом случае и составьте катодные и анодные процессы в кислой среде и среде атмосферного воздуха. Какие вещества будут продуктами коррозии?
5. Какие процессы протекают при коррозии железной пластинки в кислой среде и во влажном воздухе, если пластинка находится в контакте: а) с магниевой пластиной; б) с медной пластиной? Составьте электронные уравнения анодных и катодных процессов. С какой деполяризацией протекает коррозия?
6. В каком случае коррозия цинковой пластинки протекает быстрее: а) при контакте с железной пластинкой; б) при контакте с оловянной пластинкой? Почему?
Рекомендуемая литература:
1. Коровин Н.В. Общая химия: учеб. рек. Мин. обр. РФ/ Н.В. Коровин. – М.: Высшая школа, 2009. – 558 с.
2. Глинка, Н.Л. Задачи и упражнения по общей химии: учеб. пособие: рек. Мин. обр. РФ/ Н.Л. Глинка. – Л.: Химия, 2006. – 240 с.
3. Ахметов, Н.С. Лабораторные и семинарские занятия по общей и неорганической химии: Учеб. пособие: Рек. Мин. обр. РФ / Ахметов Н.С., Азизова М.К., Бадыгина Л.И. - М.: Высш. шк., 2002. - 368с. с.
4. Тестовые задания по общей и неорганической химии с решениями и ответами: учеб. пособие / Р. А. Лидин [и др.]. – М.: БИНОМ; М.: Лаборатория знаний, 2004. – 231 с.
5. Родина, Т.А. Практикум по общей и неорганической химии: учеб. пособие/ Т.А. Родина, А.В. Иванов, В.И. Митрофанова; АмГУ, ИФФ. – Благовещенск: Изд-во Амур. гос. ун-та, 2008. – 208 с.
Практическое занятие 9: Законы электролиза (решение задач)
Цель занятия: Формирование необходимого комплекса знаний об электрохимических процессах и их количественных характеристиках. Формирование навыков использования фундаментальных законов и основных понятий химической науки в области электрохимии для понимания характеристик процессов, используемых в современной промышленности и в быту.
Требования к знаниям, которые студент должен приобрести в результате освоения темы:
знать:основные положения теории электрохимических процессов (электролиз)
уметь: составлять уравнения процессов, протекающих на электродах при электролизе, рассчитывать их количественные характеристики
Теоретическая часть:
Превращение электрической энергии в химическую происходит при электролизе. Этот процесс широко используется в металлургии, химической промышленности, при получении гальванопокрытий.
Под электролизом понимают окислительно-восстановительный процесс, протекающий на электродах при пропускании постоянного электрического тока через расплав или раствор электролита.
 Процесс электролиза осуществляется в специальных установках, называемых электролизерами, конструкции которых определяются получаемыми продуктами. Простейший электролизер (рис. 9) состоит из специальной емкости (1), заполненной раствором или расплавом электролита (2), в которую погружаются электроды (3, 4). Электроды соединяются с положительным и отрицательным источниками постоянного тока. На электроде, подключенном к отрицательному источнику тока – катоде (4) – происходит процесс восстановления. Электрод, подключенный к положительному источнику тока – анод (3) – участвует в процессе окисления. В зависимости от состояния исходного вещества, подвергаемого электролизу, различают электролиз расплавов и электролиз растворов. Процесс электролиза зависит также от используемых электродов, которые могут быть как инертными (графитовыми, угольными, платиновыми), так и активными (растворимыми). В качестве активных электродов используются растворимые аноды, изготовленные из меди, никеля, кадмия, алюминия и др. металлов, непосредственно участвующие в процессе электролиза.
Процесс электролиза осуществляется в специальных установках, называемых электролизерами, конструкции которых определяются получаемыми продуктами. Простейший электролизер (рис. 9) состоит из специальной емкости (1), заполненной раствором или расплавом электролита (2), в которую погружаются электроды (3, 4). Электроды соединяются с положительным и отрицательным источниками постоянного тока. На электроде, подключенном к отрицательному источнику тока – катоде (4) – происходит процесс восстановления. Электрод, подключенный к положительному источнику тока – анод (3) – участвует в процессе окисления. В зависимости от состояния исходного вещества, подвергаемого электролизу, различают электролиз расплавов и электролиз растворов. Процесс электролиза зависит также от используемых электродов, которые могут быть как инертными (графитовыми, угольными, платиновыми), так и активными (растворимыми). В качестве активных электродов используются растворимые аноды, изготовленные из меди, никеля, кадмия, алюминия и др. металлов, непосредственно участвующие в процессе электролиза.
Количественно процесс электролиза описывается законами М. Фарадея (1833 г.):
Ø Первый закон Фарадея: масса веществ, выделившихся на электродах в процессе электролиза, пропорциональна их эквивалентам и количеству пропущенного электричества. Математически первый закон Фарадея можно выразить формулой:
m = 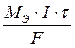
где m – масса вещества, выделившегося на электроде, г;
МЭ – молярная масса эквивалента вещества, выделившегося на электроде, г/моль;
I – сила тока, А;
τ – время протекания процесса, с;
F – постоянная Фарадея, F = 96485,309 Кл/моль (F ≈ 96500 Кл/моль);
I ∙ τ = Q – количество электричества, Кл.
Ø Второй закон Фарадея: при пропускании одного и того же количества электричества массы веществ, выделившихся на электродах, прямо пропорциональны молярным массам их эквивалентов.
 =
= 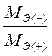
где m(–) и m(+) – массы веществ, выделившихся на катоде и аноде, соответственно, г;
МЭ(–) и МЭ(+) – молярные массы эквивалента веществ, выделившегося на электродах, г/моль.
Если одно из выделяющихся на электроде веществ – газ, законы Фарадея могут иметь вид:
V = 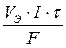
где V – объем вещества, выделившегося на электроде, л;
VЭ – эквивалентный объем вещества, выделившегося на электроде, л/моль.
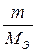 =
= 
где V и VЭ – объем вещества (л) и эквивалентный объем вещества (л/моль) выделившегося на одном электроде;
m и МЭ – масса (г) и молярная масса эквивалента (г/моль) вещества, выделившегося на другом электроде.
Поскольку в реально протекающих процессах возможны побочные реакции, эффективность процессов электролиза оценивают выходом по току – величиной, выражающей в процентах отношение количества фактически затраченного электричества к теоретически необходимому:
ВТ = 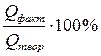
Достаточно часто выход по току определяют как отношение массы фактически выделившегося на электроде вещества к массе, рассчитанной по закону Фарадея:
ВТ = 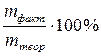
Так как процессы электролиза расплавов и растворов принципиально отличаются друг от друга, рассмотрим эти процессы.
При электролизе расплавов образуются только ионы вещества, образующего расплав. Например, при расплавлении хлорида кальция происходит процесс его термической диссоциации по схеме:
CaCl2 → Ca2+ + 2Cl–
При пропускании электрического тока начинается направленное движение ионов к соответствующим (инертным) электродам, в результате чего на электродах будут протекать следующие процессы:
Катод (–): Са2+ + 2ē → Са0 (восстановление)
Анод: 2Сl– – 2ē → Cl2↑ (окисление)
При электролизе расплавов оснований и кислородсодержащих солей на инертных электродах будут проходить следующие процессы:
Ø Электролиз расплава NaOH: на катоде будет происходить восстановление металла, на аноде – окисление кислорода гидроксогруппы
Катод (–): Nа+ + 1ē → Nа0 (восстановление)
Анод: 4OH– – 4ē → O2↑ + 2H2O (окисление)
Ø Электролиз расплава Na2SO3: на катоде будет происходить восстановление металла, на аноде – окисление аниона, так как сера в составе аниона находится в промежуточной степени окисления (S+4):
Катод (–): Nа+ + 1ē → Nа0 (восстановление)
Анод: SO32– – 2ē → SO3↑0 (окисление)
Ø Электролиз расплава Na2CO3: на катоде будет происходить восстановление металла, на аноде – окисление кислорода, входящего в состав аниона, так как углерод в составе аниона находится в высшей степени окисления (С+4):
Катод (–): Nа+ + 1ē → Nа0 (восстановление)
Анод: 2СО32– – 4ē → О2↑+ 2СО2↑ (окисление)
При электролизе растворов помимо ионов вещества, подвергающегося электролизу, в растворе присутствуют молекулы воды, которые также могут участвовать в процессе. Поэтому существует ряд закономерностей, описывающих процессы электролиза растворов. В зависимости от активности металла катодный процесс может выглядеть следующим образом. Катионы активных металлов, расположенных в ряду напряжений металлов включительно до алюминия, на катоде не разряжаются. Вместо этого на катоде происходит восстановление воды:
2Н2О + 2ē → Н2↑ + 2ОН–
Поэтому электролиз, целью которого является получение активного металла, является энергозатратным и дорогостоящим процессом, поскольку необходимо использовать исключительно расплав.
Для менее активных металлов (от марганца до свинца, включительно) катодный процесс зависит от концентрации раствора. Из концентрированных растворов на катоде восстанавливаются металлы, из разбавленных – металл и водород:
Меn+ + nē → Me0
2Н2О + 2ē → Н2↑ + 2ОН–
Катионы неактивных металлов, расположенных в ряду напряжений металлов правее свинца, легко разряжаются на катоде, и происходит восстановление металла:
Меn+ + nē → Me0
Протекание анионного процесса тоже имеет свои особенности. Анионы бескислородных кислот (HCl, HBr, HI, H2S) разряжаются на электроде с образованием соответствующих молекул.
2Сl– – 2ē → Cl2↑
Исключение составляет HF.
Анионы кислородсодержащих кислот (и ион F–) на электроде не разряжаются, вместо этого происходит следующие процессы:
Ø в кислотной и нейтральной средах:
2Н2О – 4ē → O2↑ + 4Н+
Ø в щелочной среде:
4ОН–– 4ē → О2↑ + 2Н2О
Все рассмотренные выше процессы имеют место при использовании инертных электродов. В случае использования растворимого анода металл, из которого выполнен анод, переходит в раствор, а на катоде происходит восстановление такого же количества металла. Окисление металла анода может быть выражено схемой:
Me0 – nē → Меn+
Процессы электролиза широко используются как в промышленности, так и в аналитической химии, и других отраслях науки. Электролизом получают многие чистые вещества и соединения. Использование электролиза в цветной металлургии позволяет извлекать металлы из руд и проводить их очистку. Распространенным способом очистки металлов является их электрорафинирование – процесс электролиза с растворимым анодом. Также электролиз широко используется при нанесении металлических покрытий на различные поверхности. В данной области, называемой гальванотехникой, используется два основных метода. Гальваностегия представляет собой осаждение на поверхность материала или изделия металла, гальванопластика – это получение металлических рельефных копий с использованием процесса электролиза. Процессы электролиза положены в основу таких методов исследования, как кулонометрия, кондуктометрия, потенциометрия.
Практическая часть (примеры решения задач):
Задача 1: Составьте уравнения процессов, происходящих на инертных электродах при электролизе расплава и раствора бромида калия.
Решение: При электролизе расплава образуются только ионы вещества, образующего расплав. При расплавлении бромида калия происходит процесс его термической диссоциации по схеме:
КBr → К+ + Br–
В процессе электролиза при пропускании электрического тока начинается направленное движение ионов к соответствующим электродам, то есть положительный ион калия будет двигаться к катоду, а отрицательно заряженный ион хлора – к аноду. Поэтому на электродах будут протекать следующие процессы:
Катод (–): К+ + 1ē → К0 (восстановление)
Анод: Br– – 1ē → Br0 (окисление)
Br0 + Br0 = Br2↑
Суммарное уравнение процесса электролиза расплава будет иметь вид:
электролиз
 2КВr(расплав) К0 + Br2↑
2КВr(расплав) К0 + Br2↑
Электролиз раствора бромида калия будет выглядеть иначе. В растворе будет происходить диссоциация бромида калия:
КBr ⇄ К+ + Br–
Поскольку калий является активным металлом, на катоде будет происходить восстановление молекул воды, а ионы К+ останутся в околокатодном пространстве. На аноде будет происходить окисление ионов брома, поскольку Br– является ионом бескислородной кислоты HBr.
Катод: 2Н2О + 2ē → Н2↑ + 2ОН– (восстановление)
Анод: Br– – 1ē → Br0 (окисление)
Br0 + Br0 = Br2↑
Суммарное уравнение процесса электролиза раствора будет иметь вид:
электролиз
 2КВr + 2Н2О Н2↑ + Br2↑ + 2КОН
2КВr + 2Н2О Н2↑ + Br2↑ + 2КОН
Задача 2: Составьте уравнения процессов, происходящих на инертных электродах при электролизе раствора нитрата меди (II) и рассчитайте массу (объем) веществ, выделившихся на электродах, если процесс электролиза проходил в течение 1,5 часов при силе тока 10А.
Решение: Диссоциация нитрата меди в водном растворе будет происходить по схеме:
Cu(NO3)2 ⇄ Cu2+ + 2NO3–
Медь является неактивным металлом и располагается в ряду напряжений металлов правее водорода. Поэтому на катоде будет происходить восстановление меди. Анион NO3– является остатком кислородсодержащей кислоты, поэтому на аноде будет происходить окисление воды:
Катод: C2++ 2ē → Cu0 (восстановление)
Анод: 2Н2О – 4ē → O2↑ + 4Н+ (окисление)
Суммарное уравнение процесса электролиза раствора будет иметь вид:
электролиз
 Cu(NO3)2 + 2Н2О 2Cu + 4НNO3 + O2↑
Cu(NO3)2 + 2Н2О 2Cu + 4НNO3 + O2↑
Так как в процессе электролиза на катоде выделяется медь (твердое вещество), а на аноде кислород (газ), рассчитаем соответственно, их массу и объем на основании первого закона Фарадея.
m = 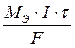
V = 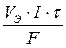
Для выполнения расчетов необходимо определить молярную массу эквивалента меди и эквивалентный объем кислорода, а также привести время к требуемым для расчета единицам измерения (секунды).
МЭ(Cu) = М ∙ fЭ = 63,546 ∙ ½ = 31,773 г/моль
VЭ(О2) = 22,4 ∙ fЭ = 22,4 ∙ ¼ = 5,6 л/моль
τ = 1,5 час = 5400 с
m(Cu) = 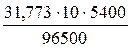 = 17,78 г
= 17,78 г
V(О2) = 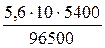 = 3,13 л
= 3,13 л
Задача 3: Какое вещество и в каком количестве выделится при электролизе раствора сульфата никеля на аноде, если на катоде выделилось 88,5 г металла?
Решение: Процесс электролиза сульфата никеля в водном растворе будет происходить следующим образом:
Диссоциация: NiSO4 ⇄ Ni2+ + SO42–
Катод: Ni2+ + 2ē → Ni0 (восстановление)
Анод: 2Н2О – 4ē → O2↑ + 4Н+ (окисление)
Суммарное уравнение процесса электролиза:
электролиз
 NiSO4 + 2Н2О 2Ni + 2Н2SO4 + O2↑
NiSO4 + 2Н2О 2Ni + 2Н2SO4 + O2↑
Таким образом, веществами, выделяющимися на электродах, будут никель и кислород. Поскольку условия протекания процесса электролиза (время, сила тока) не заданы, воспользуется для расчетов вторым законом Фарадея применительно к газам:
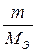 =
= 
МЭ(Ni) = М ∙ fЭ = 58,69 ∙ ½ = 29,345 г/моль
VЭ(О2) = 22,4 ∙ fЭ = 22,4 ∙ ¼ = 5,6 л/моль
V(О2) = 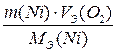 =
= 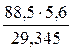 =16,89 л
=16,89 л
Контрольные вопросы:
1. Какой процесс называется электролизом?
2. Укажите способы проведения процесса.
3. Опишете принцип работы электролизера.
4. Сформулируйте законы электролиза.
5. Какие процессы происходят при электролизе расплавов?
6. В чем различие электролиза расплавов и электролиза растворов?
7. Запишите процессы, происходящие на инертных электродах при электролизе водных растворов солей металлов с разной активностью.
8. Чем отличаются продукты электролиза водных растворов солей, содержащих анионы бескислородных и кислородсодержащих кислот?
9. В чем разница в процессах электролиза расплава и раствора хлорида натрия, сульфата алюминия, нитрата серебра?
10. Какие процессы происходят при электролизе с растворимым анодом? Как используется данный процесс?
11. Приведите примеры использования процессов электролиза.
Контрольные задания:
1. Составьте уравнения катодных и анодных процессов, происходящих при электролизе гидроксида алюминия (расплав), хлорида меди (раствор), нитрата кобальта (раствор), фторида кальция (расплав).
2. Объясните, чем обусловлены различия между процессами электролиза расплава и электролиза раствора на примере фосфата натрия.
3. Для одной из солей, приведенных в задании 1, рассчитайте количество продуктов, выделившихся на инертных электродах, если процесс электролиза происходил в течение 35 минут при силе тока 15 А.
4. Определите молярную массу эквивалента металла, выделившегося на катоде, если при электролизе водного раствора соли этого металла на аноде выделилось 0,168 л кислорода.
5. Какова сила тока, пропущенного через раствор хлорида меди в течение 1,5 часов, если на аноде выделилось 33,6 л газа? Составьте уравнения процессов, происходящих на инертных катоде и аноде.
Рекомендуемая литература:
1. Коровин Н.В. Общая химия: учеб. рек. Мин. обр. РФ/ Н.В. Коровин. – М.: Высшая школа, 2009. – 558 с.
2. Глинка, Н.Л. Задачи и упражнения по общей химии: учеб. пособие: рек. Мин. обр. РФ/ Н.Л. Глинка. – Л.: Химия, 2006. – 240 с.
3. Ахметов, Н.С. Лабораторные и семинарские занятия по общей и неорганической химии: Учеб. пособие: Рек. Мин. обр. РФ / Ахметов Н.С., Азизова М.К., Бадыгина Л.И. - М.: Высш. шк., 2002. - 368с. с.
4. Тестовые задания по общей и неорганической химии с решениями и ответами: учеб. пособие / Р. А. Лидин [и др.]. – М.: БИНОМ; М.: Лаборатория знаний, 2004. – 231 с.
5. Родина, Т.А. Практикум по общей и неорганической химии: учеб. пособие/ Т.А. Родина, А.В. Иванов, В.И. Митрофанова; АмГУ, ИФФ. – Благовещенск: Изд-во Амур. гос. ун-та, 2008. – 208 с.
Дата добавления: 2015-09-11; просмотров: 3153;

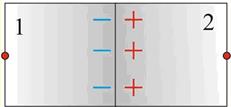 Рис.5. Образование
контактного потенциала
Рис.5. Образование
контактного потенциала