Предмет и задачи коллоидной химии. Представление о коллоидном состоянии вещества. Этапы развития коллоидной химии. Классификация дисперсных систем.
Ранее коллоидная химия считалась разделом физической химии, а теперь является самостоятельной дисциплиной.
Предметом изучения коллоидной химии являются гетерогенные смеси веществ (дисперсные системы), их свойства, процессы, протекающие в этих системах.
Задачи коллоидной химии – прогнозирование направления и изучение осо-бенностей протекания физико-химических процессов в дисперсных системах.
Коллоидная химия использует особые методы исследования, как электронная микроскопия, ультрамикроскопия, ультрацентрифугирование, электрофорез, нефелометрия и др.
Для более отчётливого представления роли коллоидной химии кратко остановимся на истории развития этой науки.
Коллоидные системы начали изучать в середине 19 века. В 1845 г. итальян-ский ученый Франческо Сельми установил, что некоторые нерастворимые в воде вещества (например, AgCl, S, берлинская лазурь), в определенных условиях растворяются, образуют однородные растворы, выпадение осадка не сопровож-дается изменением температуры, т.е. аномальное поведение вещества. Он назвал их псевдорастворами. Позднее они по предложению К.Негели получили название «золь». В 1857 году М.Фарадей открыл отличительный признак псевдорастворов – рассеяние света.
Основоположником коллоидной химии считается английский ученый Томас Грэм. Он изучил растворы Сельми и установил (1861 год), что они отличаются от хорошо растворимых в воде соединений. Эти соединения в растворе образуют не кристаллические, а рыхлые аморфные осадки, диффундируют медленно, не проходят через полупроницаемые мембраны с отверстиями молекулярного раз-мера. Это указывало на большой размер частиц таких соединений. Растворы и вещества, которые их образуют, Грэм назвал коллоидами (от гр. kolla – клей + eidos вид), т.к. он проводил эксперименты желатиной, растворы которой используют в качестве столярного клея и считал, что клей является одним из представителей этих соединений. Основные отличительные положения «Коллоидной химии» Т.Грэма заключаются в следующем:
1) свойства коллоидных систем в сильной степени зависят от размеров частиц дисперсной фазы;
2) все коллоидные системы способны интенсивно рассеивать свет;
3) диффузия дисперсных частиц в коллоидных системах выражена в минимальной степени;
4) коллоидные системы способны к диализу;
5) коллоидные системы являются термодинамически неустойчивыми.
Одним из недостатков высказанных концепций Т.Грэма было разделение им всех веществ на два мира. Грэм считал, что коллоиды по своей природе отличаются от обычных веществ и все вещества разделил на две группы – кристаллоиды (обычные вещества, кристаллизующиеся при насыщении раствора) и коллоиды (клееподобные вещества).
Позже русский ботаник И.Г.Борщов (1869 год) установил зависимость ско-рости диффузии коллоидных частиц от их размера и пришел к выводу, что коллоиды имеют кристаллическое строение.
В начале 20 века П.П.Веймарн (1907–1912 г.г.) изучил около 200 веществ и по-казал, что одно и то же вещество может в одних условиях обладать свойствами кристаллоида, а в других – коллоида. Так, канифоль в спирте образует истинный раствор, а в воде – коллоидный раствор, или при растворении NaCl в воде обра-зуется истинный раствор, а в бензоле – коллоидный. Таким образом, установле-но, что правильнее говорить не о коллоидном веществе, а о коллоидном состоянии вещества.
В 1903 году чешский ученый Р.Зигмонди и немецкий ученый Г.Зидентопф сконструировали ультрамикроскоп, с помощью которого можно проводить прямые наблюдения за частицами коллоидного раствора.
Позднее (1907 год) Ф.Ф.Рэлей, М.Смолуховский, А.Эйнштейн установили, что вещество коллоидных растворов находится не в виде отдельных молекул или ионов, а в виде скоплений – агрегатов молекул, названных мицеллами (от лат. micella крошка, крупинка). А.Эйнштейн и М.Смолуховский развили молекулярно-статистическую теорию броуновского движения коллоидных частиц и теорию флуктуаций. Ж.Б.Перрен, Т.Сведберг провели проверку данной теории, определив независимыми путями число Авогадро. В.Оствальдом в начале 20 века достаточно полно было изучено влияние агрегативного состояния и дисперсности на свойства коллоидных объектов.
В 1920 году Н.П.Песковым были введены 2 понятия (вида) устойчивости дисперсных систем: агрегативная и седиментационная устойчивости. Теория строения двойного электрического слоя была развита в работах Х.Гельмгольца и Ж.Перрена (80-ые годы ХХ века) , Г.Гуи и Д.Чапмена (1910 и 1913 г.г.), О.Штерна (1924 г.) и позднее в середине ХХ века в работах А.Н.Фрумкина.
П.П.Веймарн детально изучал конденсационные методы образования лиозолей. Теорией образования аморфных и кристаллических частиц при синтезе коллоидных систем занимался В.А.Каргин. Ф.Ф.Рэлей, а позднее Л.И.Мандельштам, П.Дебай разработали основы теории светорассеяния на неоднородностях среды и успешно применяли эти концепции для анализа коллоидных систем. В 1908 г. Г.Фрейндлих сформулировал основные положения адсорбционной теории коагуляции. Б.В.Дерягин, А.Д.Ландау, Е.Фервей, Т.Овербек разрабатывали (1939-1943 г.г.) и развивали физическую теорию коагуляции. Г.Кройтом предложена теория коагуляции ВМС.
В настоящее время коллоидными считаются такие дисперсные системы, в которых размер частиц составляет 1–100 нм (или 1.10–7–1.10–9 м). Эти границы условны, т.к. имеются системы с более или менее крупными частицами, обла-дающими свойствами коллоидных растворов и те, имея такие же размеры, не проявляют свойств коллоидных растворов. Поэтому можно отметить, что коллоидная система представляет собой дисперсию одного тела в другом, а коллоидная химия изучает физические закономерности поверхностных явлений и обусловленными ими свойства коллоидных растворов. Отсюда вытекает, что коллоидная химия – это наука о свойствах гетерогенных высокодисперсных систем и о протекающих в них процессах.
Следует отметить, что имеются вещества с очень большими молекулами – высокомолекулярные соединения (белки, целлюлоза, каучук и др. полимеры). Молекулы таких соединений могут превышать размеры коллоидных частиц, их растворы могут обладать многими свойствами коллоидных растворов, но не являются скоплениями молекул. Их нельзя отнести к типичным коллоидным системам. Чтобы различить, их называют растворами ВМС. Растворы ВМС также являются объектами изучения коллоидной химии.
Коллоидные системы и растворы ВМС широко распространены в природе. Белки, кровь, лимфа, углеводы, пектины находятся в коллоидном состоянии. Многие отрасли производства (пищевая, текстильная, резиновая, кожевенная, лакокрасочная, керамическая промышленности, технология искусственного волокна, пластмасс, смазочных материалов) связаны с коллоидными системами. Производство строительных материалов (цемент, бетон, вяжущие растворы) основано на знании свойств коллоидов. Угольная, торфяная, горнорудная и нефтяная промышленность имеют дело с дисперсными материалами (пылью, суспензиями, пенами). Особое значение коллоидная химия приобретает в про-цессах обогащения полезных ископаемых, дробления, флотации и мокрого обо-гащения руд. Фото- и кинематографические процессы также связаны с приме-нением коллоидно-дисперсных систем.
К объектам коллоидной химии следует отнести все многообразие форм рас-тительного и животного мира, в частности, типичными коллоидными образова-ниями являются мышечные и нервные клетки, клеточные мембраны, волокна, гены, вирусы, протоплазма, кровь. Поэтому ученый-коллоидник И.И.Жуков констатировал, что «человек по существу – ходячий коллоид». В свете этого, технологию лекарственных средств (мазей, эмульсий, суспензий, аэрозолей, порошков), действие различных лекарств на организм невозможно представить без знаний коллоидной химии.
Дисперсная система. Мера дисперсности.
Дисперсными системами называются неоднородные (гетерогенные) смеси веществ, в которых одно тонкоизмельченное вещество равномерно распределено в однородной среде (массе) другого вещества.
Дисперсные системы состоят из дисперсной фазы и дисперсионной среды. Дисперсная фаза (ДФ) – совокупность мелких частиц вещества, распределенных (диспергированных) в однородной среде другого вещества.
Дисперсионная среда – это однородная среда в виде молекул или ионов, в которой равномерно распределяются мелкие частицы другого вещества.
Дисперсная система, в отличие от гомогенных (истинных) растворов, характеризуется гетерогенностью и дисперсностью.
Гетерогенность – это многофазность системы, т.е наличие границ раздела фаз, что обусловлено нерастворимостью вещества одной фазы в другой. Так как только между такими веществами могут существовать физические поверхности раздела.
Дисперсность – это мера раздробленности одного вещества дисперсной сис-темы. По мнению А.В. Думанского (1913 г.) мерой раздробленности дисперсной системы может служить поперечный размер частиц (R) или степень дисперс-ности (D): D = 1/R (м─1). Чем меньше размер частиц, тем больше степень дисперсности. Системы с разными размерами частиц называются полидис-персными, а с частицами одинакового размера – монодисперсными. Так как размеры частиц в реальных системах различны, то степень дисперсности не очень точно характеризует систему. Поэтому в 1909 г. за меру раздробленности В.Оствальд предложил использовать удельную поверхность (Sуд.): 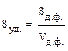 , где Sд.ф. и Vд.ф. – площадь поверхности и объем дисперсной фазы. Удельную поверхность можно вычислить, если известны размер и форма частиц: в случае частиц кубической формы
, где Sд.ф. и Vд.ф. – площадь поверхности и объем дисперсной фазы. Удельную поверхность можно вычислить, если известны размер и форма частиц: в случае частиц кубической формы 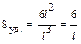 , а в случае сферических частиц:
, а в случае сферических частиц: 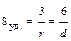 . Где l – длина ребра куба, r и d – радиус и диаметр сферы. Все показатели взаимосвязаны между собой уравнением Sуд. = k.D = k/R. Как видно из уравнения, удельная поверхность связана с дисперсностью. С увеличением дисперсности удельная поверхность резко возрастает, например, если R = 0,1 см, то Sуд.= 30 см-1, а при R = 10-7 cм, то Sуд. составит 30 см+7 см-1, т.е. 1 см3 этих частиц имеют поверхность раздела фаз, равная 3000 м2. Повышение удельной поверхности обуславливает специфические свойства дисперсных систем, связанных с поверхностными явлениями.
. Где l – длина ребра куба, r и d – радиус и диаметр сферы. Все показатели взаимосвязаны между собой уравнением Sуд. = k.D = k/R. Как видно из уравнения, удельная поверхность связана с дисперсностью. С увеличением дисперсности удельная поверхность резко возрастает, например, если R = 0,1 см, то Sуд.= 30 см-1, а при R = 10-7 cм, то Sуд. составит 30 см+7 см-1, т.е. 1 см3 этих частиц имеют поверхность раздела фаз, равная 3000 м2. Повышение удельной поверхности обуславливает специфические свойства дисперсных систем, связанных с поверхностными явлениями.
Классификация дисперсных систем.
Дисперсные системы классифицируют по размерам частиц, по агрегатному состоянию веществ, по интенсивности взаимодействия фаз системы. Они разли-чаются также по скорости диффузии частиц, по способности проходить через мембраны и фильтры, по рассеиванию света.
По размеру частиц различают молекулярно-дисперсные (r < 1.10–9 м), коллоидно-дисперсные (1.10–7–1.10–9 м), микрогетерогенные (1.10–4–1.10–7 м) и грубодисперсные системы (r >1.10–4м).
Молекулярно-дисперные системы или истинные растворы. В этих системах молекулы или ионы не обладают поверхностью в обычном понимании и поэтому их не рассматривают дисперсной системой. Их выделяют только для сравнения свойств коллоидных растворов и микрогетерогенных систем. Размер частиц меньше 1 нм или 1.10–9 м. Вещество раздроблено до предела и поэтому такие системы совершенно однородны. Эти системы термодинамически устойчивы: частицы из-за малой величины имеют большую скорость диффузии, они прохо-дят через полупроницаемые мембраны, фильтры, их не видно в оптическом мик-роскопе. Истинные растворы прозрачны, не рассеивают свет. Примерами истин-ных растворов являются водные растворы хорошо растворимых солей, органи-ческих соединений, жиров в органических растворителях, смеси газов и др.
Коллоидно-дисперсные системы. Размеры частиц дисперсной фазы в таких системах колеблется в пределах 1–100 нм (или 1.10–7–1.10–9 м). Эти частицы хотя и не слишком велики, но имеют поверхность раздела, поэтому коллоидные системы иногда называют ультрамикрогетерогенными. Коллоидные системы термодинамически малоустойчивы; коллоидные частицы способны к диффузии, проходят через бумажные фильтры, но не проходят через полупроницаемые мембраны, задерживаются на ультрафильтрах, не видимы в оптический микро-скоп, но наблюдаются в ультрамикроскопах, имеют электрический заряд (двойной электрический слой), движутся в электрическом поле. Коллоидные растворы прозрачны, но рассеивают свет (проявляют эффект Фарадея-Тиндаля). Примерами коллоид-ных систем служат дым, туман, жидкие коллоидные растворы трудно растворимых в воде соединений.
Микрогетерогенные системы (взвеси, порошки, эмульсии, пены). Размер частиц 1.10–4–1.10–7 м. Эти системы термодинамически неустойчивы: довольно быстро разрушаются вследствие оседания частиц. Частицы не способны к диф-фузии, не проходят даже через бумажные фильтры, видны в оптический микро-скоп. Растворы мутны вследствие поглощения света, отражения и преломления его частицами. Примеры: взвеси глины, ила, песка в воде, облака пыли, порошки и др.
Классификация по агрегатному состоянию дисперсной фазы и дисперсионной среды (по В.Оствальду)
Учитывая, что вещество может находиться в трех агрегатных состояниях, возможны 8 комбинаций дисперсионной среды и ДФ:
| ДС | ДФ | Условное обозначение системы | Тип системы | Примеры |
| Газ | Газ Жидкость Твердое тело | Г–Г Г–Ж Г–Т | Аэрозоли | Нет (гомогенные системы). Туман, облака, аэрозоли жидких лекарств. Дым, пыль, порошки, аэрозоли твердых лекарств. |
| Жидкость | Газ Жидкость Твердое тело | Ж–Г Ж–Ж Ж–Т | Лиозоли | Пены, крем, газированная вода Эмульсии, нефть, молоко, сливки. Суспензии, зубные пасты, тушь, глины. |
| Твердое тело | Газ Жидкость Твердое тело | Т–Г Т–Ж Т–Т | Солидозоли | Твердые пены (пемза, хлеб, резина, лава, пенобетон, пенопласт) Жемчуг, некоторые минеральные гели, опал, желе, желатин, агар-агар Сплавы, стекла, минералы (рубин) |
Для отличия коллоидных растворов от других дисперсных систем, их называют золями (от лат. solutio раствор). Поэтому системы, в которых дисперсионной средой является газ называют аэрозолями, в случае жидкости – лиозолями, в случае твердой дисперсионной среды – солидозолями. В зависимости от природы жидкой дисперсионной среды лиозоли делят на гидрозоли, алказоли, бензозоли, этерозоли (органозоли).
Классификация по взаимодействию дисперсионной среды и дисперсной фазы (по Г.Фрейндлиху)
Такая классификация пригодна только для систем с жидкой дисперсионной средой.
Если поверхность частиц и молекула растворителя имеют одинаковую по-лярность (т.е. сродство), то они будут взаимодействовать друг с другом. Поэто-му вокруг коллоидных частиц образуются толстые многослойные сольватные оболочки. Фрейндлих таких систем назвал лиофильными (от гр. lyo жидкость + phileo люблю). Примерами таких систем являются растворы белка, крахмала, агар-агара, гуммиарабика, высококонцентрированные эмульсии, эмульсолы. В случае, когда частицы и молекулы растворителя разнополярны, то между коллоидными частицами и дисперсионной средой отсутствует взаимодействие, значит отсутствуют и сольватные оболочки, либо образуются тонкие сольватные оболочки. Такие системы были названы лиофобными коллоидными растворами (от гр.lyo жидкость + phobos боязнь). В случае, когда дисперсионной средой является вода, эти системы называются соответственно, гидрофильными и гидрофобными.
К лиофобным системам относятся типичные коллоидные системы, образо-ванные трудно растворимыми в дисперсионной среде веществами (слабые осно-вания, некоторые соли, металлы, аэрозоли, пены).
Лиофильные системы не обладают всеми типичными коллигативными свойствами, они растворяются самопроизвольно, термодинамически устойчивы, образуют гомогенные растворы. Поэтому лиофильных систем в настоящее время выделяют как особые группы дисперсных систем – растворы высокомо-лекулярных веществ (белков, полисахаридов, нуклеиновых кислот) и мицелярные растворы ПАВ.
Дата добавления: 2015-11-12; просмотров: 9783;
