Лекция 2. Закон действия масс. Классификация катионов. Первая аналитическая группа катионов.
Закон действия масс. Каждая химическая реакция протекает в течение некоторого промежутка времени и имеет определенную скорость. Скорость реакции характеризуется количеством вещества, вступившего в реакцию в единицу времени, или изменением концентрации одного из реагирующих веществ в единицу времени. Скорость реакции зависит от природы реагирующих веществ, от их концентрации, температуры и катализатора.
Зависимость скорости реакции от концентрации выражается законом действия масс: скорость химической реакции при данной температуре прямо пропорциональна произведению концентрации реагирующих веществ.
При систематическом анализе принято деление катионов и анионов на аналитические группы. В на-стоящее время принята классификация катионов, разработанная Н.А. Меншуткиным в 1871 г. Все существующие ныне классификации предусматривают разделение катионов на 5 или 6 аналитических групп на основании следующих их свойств:
1. На различии растворимости хлоридов, карбонатов, сульфатов или гидроксидов.
2. На амфотерных свойствах некоторых гидроксидов.
3. На способности ряда гидроксидов образовывать комплексные аммиакаты.
Таблица1. Классификация катионов на аналитические группы
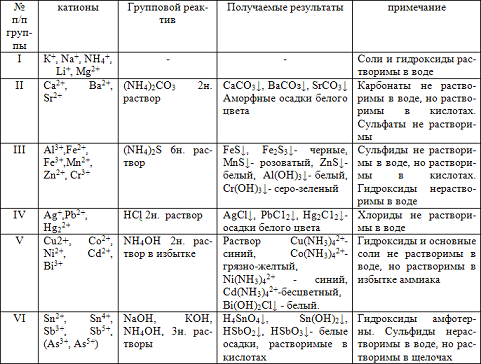
Первая аналитическая группа катионов: К+, Na+, NН4+, Mg2+
Почти все соли калия, натрия, аммония и большинство солей магния хорошо растворимы в воде. Поэтому группового реактива, осаждающего все четыре катиона, нет.
Калий и натрий относятся к 1 группе периодической системы элементов и образуют сильные щелочи. Гидроксид аммония является слабым основанием, но катион аммония близок по свойствам к катиону калия и образует несколько аналогичных малорастворимых солей. Соли аммония разлагаются при нагревании и могут быть удалены прокаливанием. Гидроксид магния - слабое основание, плохо растворимое в воде. Труднорастворимы также фосфат магния и карбонат. Гидроксокарбонат магния растворяется в избытке солей аммония и при действии карбонатом аммония в присутствии хлорида аммония в осадок не выпадает. Поэтому при систематическом анализе ион магния остается в растворе с катионами 1 группы. По этой причине он и отнесен к этой группе.
При систематическом анализе катионы калия, натрия и магния обнаруживают в последнюю оче-редь, так как катионы других групп мешают их обнаружению и должны быть удалены. В водных растворах катионы 1 группы бесцветны, образуемые ими соли имеют окраску только в тех случаях, когда в их состав входят окрашенные анионы. Соли натрия окрашивают пламя в ярко- желтый, а калия- в фиолетовый цвет, соли лития окрашивают пламя в карминно- красный цвет. Соли аммония при нагревании разлагаются с выделением аммиака NH3, который чувствуется по запаху или окрашиванию влажной индикаторной бумаге в сине- зеленый цвет.
Натрий входит в состав поваренной соли, калий – морской. Ионы калия и магния являются важ-нейшими микроэлементами для нормализации сердечной деятельности.
Оценка качества природных вод включает пробы на присутствие ионов аммония. Наличие в воде аммиака и солей аммония служит признаком загрязненности, так как эти соединения образуются при гниении белков. По этой же причины реакции на ионы аммония проводят для оценки свежести мясных и рыбных продуктов.
Продукты детского и диетического питания также подвергаются обязательному исследованию на содержание натрия, калия и магния.
Вопросы для самопроверки:
1. Сформулировать закон действия масс. Какие факторы и как влияют на скорость химической реакции?
2. Можно ли каким- либо реактивом осадить все катионы первой аналитической группы? Ответ обосновать.
3. На каком свойстве аммонийных солей основано отделение иона аммония от других ионов?
4. Можно ли «сухим» методом распознать соли натрия, калия, лития? Ответ обосновать.
5. Почему при анализе питьевой воды проводят аналитические реакции на присутствие иона аммония?
6. Почему диетологи в последнее время рекомендуют заменять поваренную соль на морскую?
Дата добавления: 2015-11-10; просмотров: 4409;
