Сущность второго закона термодинамики. Равновесные и неравновесные состояния, обратимые и необратимые процессы
Второй закон термодинамики устанавливает существование у всякой равновесной термодинамической системы однозначной функции состояния – энтропии S.
Понятие энтропии вводится в феноменологической термодинамике с помощью выражения dS= 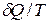 , в соответствии с которым при подводе к ТС порции теплоты
, в соответствии с которым при подводе к ТС порции теплоты 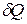 энтропия системы возрастает. Температура Т в этом выражении есть температура на границе ТС в точке, где подводится порция теплоты
энтропия системы возрастает. Температура Т в этом выражении есть температура на границе ТС в точке, где подводится порция теплоты 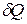 . С помощью этой специальной функции состояния можно математически описать 2-ой закон термодинамики.
. С помощью этой специальной функции состояния можно математически описать 2-ой закон термодинамики.
ТС находится в состоянии равновесия, если после ее изоляции от окружающей среды в ней не наблюдается никаких изменений, и в неравновесном состоянии, если после ее изоляции в ней обнаруживаются какие-либо изменения. Эти изменения в изолированной системе протекают самопроизвольно, и со временем система приходит в равновесное состояние. Процесс является неравновесным, если при его совершении ТС хотя бы в одной точке процесса находится в неравновесном состоянии. Неравновесные состояния ТС могут быть связаны либо с локальной неравновесностью в точке, либо с объемной неравновесностью из-за различия температур, давлений и других параметров в различных элементах объема ТС. При объемной неравновесности ТС для проведения термодинамических расчетов объем ТС можно разбить на малые объемы, в пределах которых перепады параметров (р, Т и др.) малы и состояния в пределах каждого из объемов можно считать локально равновесным.
Энтропия изолированной ТС не изменяется только при равновесных процессах в ней и всегда возрастает при неравновесных процессах. Таким образом, 2-ой закон термодинамики – закон об энтропии и состоит из принципа существования энтропии и принципа возрастания энтропии.
Все равновесные процессы – обратимые, а неравновесные – необратимые процессы. Процесс называется необратимым, если суммарный запас энергии направленного, упорядоченного движения частиц ТС (работы) уменьшается, и обратимым, если этот запас энергии сохраняется. В необратимых процессах происходит диссипация (рассеяние) энергии упорядоченного движения материи в энергию теплового, неупорядоченного движения, которую нельзя превратить ни в какой другой вид энергии в обратном направлении. Обратимый (равновесный) процесс возможен только при бесконечно малых перепадах параметров на границе ТС и окружающей среды в любой момент процесса.
Второй закон термодинамики является обобщением опытных данных, указывает на особый характер протекания тепловых процессов и устанавливает пределы возможных превращений теплоты в работу. Этот закон позволяет определить направление и условия протекания любого термодинамического процесса. Дело в том, что тепловые процессы, удовлетворяющие первому закону термодинамики, подразделяются на самопроизвольные, протекающие без внешнего воздействия в данных условиях и на процессы, которые не могут происходить в данных условиях без внешнего воздействия.
В изолированной ТС самопроизвольные процессы протекают в направлении достижения равновесия системы. При этом работа преобразуется в теплоту ( 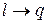 ), а теплота переходит лишь от тела с более высокой температурой к телу с более низкой температурой. Процессы с превращением теплоты в работу (
), а теплота переходит лишь от тела с более высокой температурой к телу с более низкой температурой. Процессы с превращением теплоты в работу ( 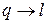 ) в изолированной системе самопроизвольно идти не могут. Открытие 2-го закона термодинамики было связано с анализом работы тепловых машин (Сади Карно).
) в изолированной системе самопроизвольно идти не могут. Открытие 2-го закона термодинамики было связано с анализом работы тепловых машин (Сади Карно).
Для осуществления процессов с превращением теплоты в работу надо создать из двух тел с различной температурой (Т1>Т2) неравновесную ТС, обладающую запасом энергии направленного упорядоченного движения частиц, а также осуществить с помощью термодинамического рабочего тела (ТРТ) обратимый цикл и передать результирующую работу цикла lц третьему телу – аккумулятору работы. При этом всю подведенную теплоту q1 нельзя превратить в работу lц. Часть теплоты необходимо отвести в холодильник 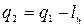 .
.
Схему превращения теплоты в работу можно представить в виде 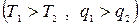 :
:
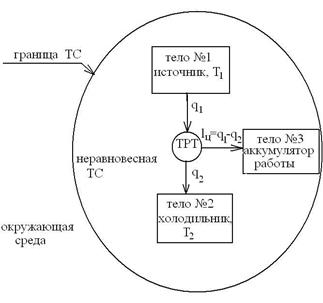
Неравноценность превращений работы в теплоту и теплоты в работу объясняется тем, что энергию направленного движения частиц (работу) можно превратить в тепловую энергию неупорядоченного, хаотического движения частиц, а обратный процесс возможен только при наличии соответствующей компенсации.
Наиболее краткой формулировкой 2-го закона термодинамики является формулировка Томсона-Кельвина: «Теплота, содержащаяся в окружающей среде, не может быть превращена в работу теплового двигателя, если температура всех окружающих тел будет одинаковой, т.е. вечный двигательII рода неосуществим».Вечный двигатель II рода – это двигатель, который производил бы механическую работу исключительно за счет теплоты окружающей среды с одинаковой температурой во всех ее точках.
Дата добавления: 2015-06-12; просмотров: 1859;
