Окончательно
d=(m/(pNА))1/3.
Произведем вычисления

1.1.4. В баллоне объемом 10 л находится гелий под давлением p1=1 МПа и при температуре T=300 К. После того как из баллона было взято m=10 г гелия,температура газа понизилась до Т=290 К Определить давление p гелия оставшегося в баллоне.
Решение. Для решения задачи воспользуемся уравнением Менделеева-Клапейрона, применив его дважды к начальному и конечному состояниям газа:
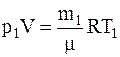 ;
;
 ,
,
где m1, m2 – массы гелия в баллоне в начальном и конечном состояниях;
m – молярная масса гелия;
R – универсальная газовая постоянная;
T1 и T2 – температуры газа в начальном и конечном состояниях.
Массы m1 и m2 гелия найдем из уравнения Менделеева-Клапейрона:
m1=p1mV/(RT1),
m2=mp2V/(RT2).
Тогда масса гелия оставшегося в баллоне будет равна
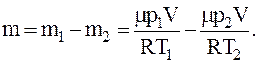
Для давления p гелия, оставшегося в баллоне, будем иметь:
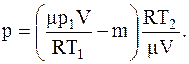
или
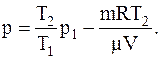
Численно
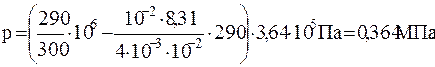 .
.
1.1.5. Баллон содержит 80 г кислорода и 320 г аргона. Давление смеси 1МПа, температура 300 К. Принимая данные газы за идеальные, определить объем баллона.
Решение. По закону Дальтона, давление смеси равно сумме парциальных давлений газов, входящих в состав смеси. Парциальные давления кислорода p1 и аргона p2 можно определить, воспользовавшись уравнением Менделеева-Клапейрона
p1=m1RT/(m1V), p2=m2RT/(m2V).
Следовательно, по закону Дальтона, давление смеси газов
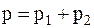 или
или 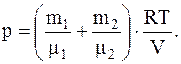
Откуда объем баллона
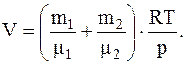
Подставив численные значения, будем иметь
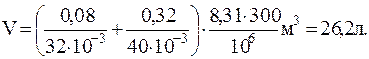
1.1.6. Какое количество молекул находится в комнате объемом 80 м3 при температуре 17 oС и давлении 750 мм. рт. ст?
Решение. Количество молекул N, содержащееся в комнате, можно определить, зная массувоздуха m,его молярную массу и число Авогадро NА. Число молекул в одном киломоле газа равно числу Авогадро. А число киломолей содержащихся в массе m, определяется соотношением:
n=m/m.
Следовательно,
N=m/(mNА).
Массу m содержащегося в комнате воздуха определяем из уравнения Менделеева-Клапейрона
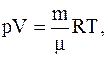
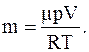
где p – давление воздуха;
V – объем;
R – универсальная газовая постоянная;
T – абсолютная температура (T=t+ 273 );
m – масса воздуха.
Следовательно, для числа молекул воздуха имеем:

Подставляя все данные, предварительно выразив их в системе СИ, будем иметь
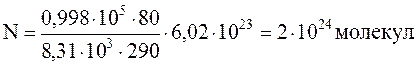
1.1.7. Найти среднюю кинетическую энергию вращательного движения одной молекулы кислорода при температуре T=350 К, а также кинетическую энергию вращательного движения всех молекул кислорода массой 4 г.
Решение. Согласно теореме о равномерном распределении энергии по степеням свободы, накаждую степень свободы приходится энергия:
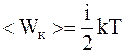 ,
,
где k – постоянная Больцмана;
Т – абсолютная температура.
Молекула кислородадвухатомная, поведение такой молекулы описывается 5-ю степенями свободы (три изних приписываются поступательному движению и две- вращательному).
Следовательно, кинетическая энергия вращательного движения молекулы кислорода может быть рассчитана по формуле:
<Wвр>=2 <Wк>=2×1/2 kТ=kТ.
Энергия вращательного движения всех молекул, содержащихся в 4 г кислорода, может быть определена как произведение числа молекул N на энергию одной молекулы:
Wк=N×<Wвр>=NkТ.
Число молекул определяется соотношением:
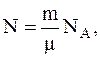
где m – молекулярная масса кислорода;
m – его масса;
NА – число Авогадро.
Таким образом
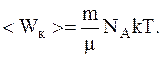
Подставив численные значения, предварительно выразив их в системе СИ, будем иметь:
<Wвр>=1,38×10-23.350=4,83×10-21 Дж;
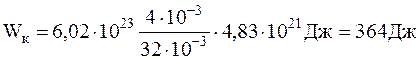 .
.
1.1.8. Масса 10 г кислорода находится при давлении 304 кПа и температуре 10 oС. После расширения вследствие нагревания при постоянном давлении кислород занял объем 10 л. Найти объем газа до расширения, температуру газа после расширения, плотности газа до и после расширения.
Решение. Согласно условию задачи, расширение газа вследствие нагревания происходило при постоянном давлении. В этом случае оказывается справедливым соотношение
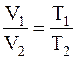 .
.
Для определения температуры газа после расширениявоспользуемся уравнениемМенделеева-Клапейрона для конечного состояния газа
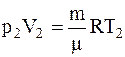 ,
,
где p2 – давление газа после расширения;
V2 – его объем после расширения;
m – масса газа;
m – молекулярная масса кислорода;
R – универсальная газовая постоянная;
T2 – абсолютная температура газа.
Следовательно, дляконечной температуры имеем
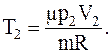
Для определения объема газа до расширения можно вновь воспользоваться уравнением Менделеева-Клапейрона, записанным для первоначального состояния газа:
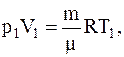
где p1, V1, T1 – его давление, объем и температура до расширения.
Из данногоуравнения имеем
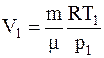 .
.
Учитывая то, что плотность газа r1=m/V1, подставляя значения V1 и V2 из уравнений Менделеева-Клапейрона, записанные для соответствующих состояний, для плотности кислорода до и после расширения будем иметь
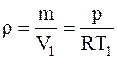 и
и 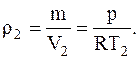
Подставляя численные значения в системе СИ, окончательно имеем:
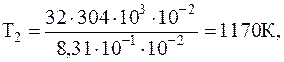

r1=4,14 кг/м3,
r2=1кг/м3.
1.1.9.Масса газа 12 г занимает объем 4 л при температуре 7 oC. После нагревания газа при постоянном давлении его плотность стала равной 0,6 кг/м3. До какой температуры нагрели газ?
Решение. Воспользовавшись уравнением Менделеева-Клапейрона
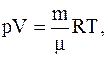
можно показать, что между плотностью газа r=m/V и давлением существует связь
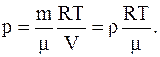
Следовательно, в начальномсостоянии давление газа:

В конечном:

Так как нагревание газа производилось при постоянном давлении, то p1=p2
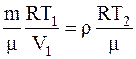 .
.
Отсюда
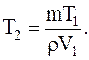
Подставляя численные значения, в системе СИ, для конечной температуры будем иметь:
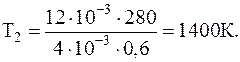
1.1.10. В баллоне находилась масса m1=10 кг газа при давлении p1=10 МПа. Какую массу газа взяли из баллона, если давление стало равным p2=2,5 МПа? Температуру газа считать постоянной.
Решение. Запишем уравнение состояния идеального газа (уравнение Менделеева-Клапейрона) для двух состояний: начального и конечного
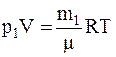 и
и 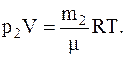
Из второгосоотношения определяем объем сосуда и подставляем его значение в первое, имеем:
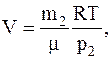
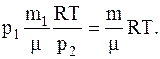
Из последнего соотношения получаемсвязь между давлением газа в сосуде и его массой для данного случая:
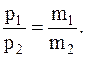
Отсюда масса газа оставшегося в баллоне:
 .
.
Так как масса израсходованного газа Dm=m1-m2,то окончательно, после соответствующих преобразований, имеем
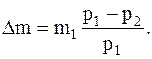
Подставляячисленные значения в системе СИ определяем массу взятого из баллона газа:
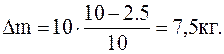
1.1.11. В сосуде находится масса m1=14 г азота и масса m2==9 г водорода при температуре 10 oС и давлении 1 МПа. Найти молярную массу смеси и объем сосуда.
Решение. По закону Дальтона давление смеси газов равно сумме парциальных давлений компонентов входящих в смесь
p=p1+p2,
где p – давление смеси;
p1 – парциальное давление азота;
p2 – парциальное давление водорода.
Из уравнения Менделеева-Клапейрона:
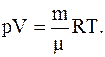
Для каждого из давлений (смеси и парциальных) можно записать:
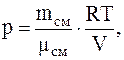
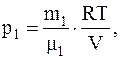
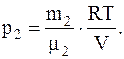
Следовательно, так как p=p1+p2, имеем

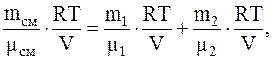
откуда
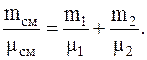
Из последнего соотношения для молекулярной массы смеси будем иметь
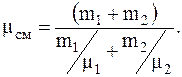
Изуравнения Менделеева-Клапейрона, для смеси газов, объем сосуда равен:
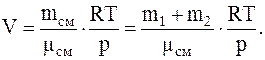
Подставляячисленные значения в системе СИнаходиммолекулярную массу смеси:
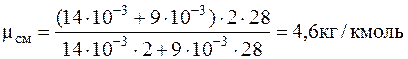
и объем сосуда
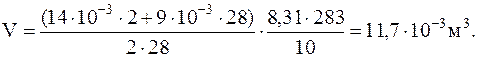
1.1.12. Для получения хорошего вакуума в стеклянном сосуде необходимо прогревать стенки сосуда при откачке для удаления, адсорбированного газа. На сколько может повыситься давление в сферическом сосуде радиусом 10 см, если адсорбированные молекулы перейдут со стенок в сосуд? Площадь поперечного сечения молекул So==10-19 м2. Температура газа в сосуде 300 oС. Слой молекул на стенках считать мономолекулярным.
Решение. Для определения давления воспользуемся основным уравнением молекулярно-кинетической теории в виде
p=nokT,
где no – число молекул в единице объема;
k – постоянная Больцмана;
Т – абсолютная температура газа.
С учетом того, что
no=N/V,
где N – число молекул в объеме V, для давления имеем
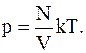
Поусловиюзадачи слой молекул в сосуде мономолекулярный, следовательно число молекул в нем можно определить исходя из соображений:
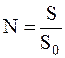
где S=4pr2 – площадь поверхности сосуда;
So – площадь поперечного сечения молекул газа.
Так как сосуд сферический, то его объем V=4/3pr3.
Таким образом, окончательно для давления газа в сосуде будем иметь соотношение:
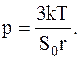
Подставляячисленные значения в полученноесоотношение в системе СИ определяем давление газа в сосуде
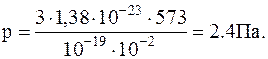
1.1.13. В воздухе содержится 23,6 % кислорода и 76,4 % азота (по массе) при давлении 100 кПа и температуре 13 oС. Найти плотность воздуха и парциальные давления кислорода и азота.
Решение. Для определения плотности воздуха воспользуемся уравнением Менделеева-Клапейрона
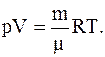
откуда
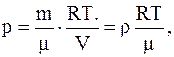 а
а 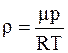 .
.
Для определения парциальных давлений также воспользуемся уравнением Менделеева-Клапейрона, записанным для каждого из компонентов, входящих в смесь воздуха:
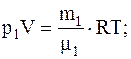
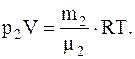
где V – объем воздуха.
Откуда
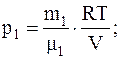
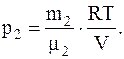
Так как r=m/V, то V=m/r, следовательно
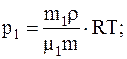
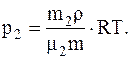
Подставляячисленные значения в системе СИ для плотности воздуха и парциальных давлений кислорода иазота будем иметь:
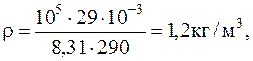
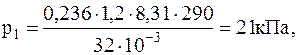
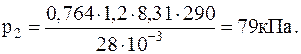
1.1.14. В сосуде находится количество n=10-7 моль кислорода и масса m2==10-6 г азота. Температура смеси 100 oС, давление в сосуде p=133 мПа. Найти объем сосуда, парциальные давления кислорода и азота и число молекул в единице объема.
Решение. Для решения задачи воспользуемся уравнением Менделеева-Клапейрона, записанным для смеси газов в виде
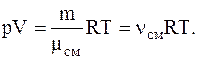
где nсм=n1+n1=(n1+m2/m2) – число молей или киломолей газов составляющих смесь.
Имеем
pV=(n1+m2/m2) RT.
Отсюда
V=(n1+m2/m2) (RT/p).
Парциальные давления компонентов образующих смесь определяем так же из уравнения Менделеева-Клапейрона, записанным для каждого из газов
p1V=n1RT и p2V =(m2/m2)RT.
Откуда для парциальных давлений кислорода и азота соответственно имеем
p1=n1RT/V;
p2=m2RT/m2V.
Для определения числа молекул в единице объема необходимо воспользоваться основным уравнением молекулярно-кинетической теории для давления
p=nokT.
Дата добавления: 2014-12-30; просмотров: 2432;
