Молекулярно-кинетическая теория идеальных газов
Система-совокупность рассматриваемых твердых, жидких и газообразных веществ. В зависимости от состояния система может обладать различными свойствами.
Параметры состояния системы: р-давление, V-объём, T-абсолютная температура.
Уравнение состояния системы -определенная функциональная связь параметров состояния:
F(p,V,T)=0
Неравновесное состояние ситемы-такое ее состояние, при котором изменяется хотя бы один из параметров состояния.
Равновесным состоянием системы– такое ее состояние, при котором все параметры имеют определённые значения, остающиеся постоянными при неизменных внешних условиях.
Процесс –переход системы из одного состояния в другое.Он всегда связан с нарушением её равновесия.
Под внутренней энергией системы понимается кинетическая энергия хаотического движения молекул, потенциальная энергия их взаимодействия и внутримолекулярнаяэнергия, т.е. энергия системы без учёта кинетической энергии её вцелом (при движении) и потенциальной энергии во внешнем поле. Внутренняя энергия является функцией состояния.
Изменение внутренней энергии при переходе системы из состояния в состояние равно разности значений внутренней энергии в этих состояниях и не зависит от пути перехода системы из одного состояния в другое.
Основными законами идеальных газов при условии постоянства одного из параметров состояния являются:
1. Произведение давления на занимаемый объём припостоянной температуре, для данной массы газа, есть величина постоянная:
pV=const, при m=const и t=const.
Такой процесс называется изотермическим.
2. При изменении температуры газа, но постоянном давлении, объём данной массы газа изменяется по закону:
Vt=Vo(1+at), при m=const, p=const,
где a-коэффициент объёмного расширения-величина, показывающая как изменился объёма газа, по отношению к его объему при 0oС, если его температура изменяется на один градус в условиях постоянного давления.
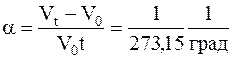 .
.
При этом T1/T2=V1/V2. Такой процесс называется изобарическим.
3. Процесс, происходящий при постоянном объёме, называется изохорическим процессом. Давление данной массы газа при изохорическом процессе изменяется по закону:
pt=po(1+bt), при m=const, V=const,
где b-термический коэффициент давления, который показывает как изменяется давление газа, по отношению к его давлению при 0 0С, если его температура изменяется на один градус в условиях постоянного объема.
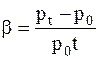 .
.
При этом
T1/T2=p1/p2.
Связь между температурой по шкале Цельсия и абсолютной температурой выражается соотношением
T=(t+273,15) К.
4. Объединив изотермический и изобарический процессы получим объединённый газовый закон: для данной массы газа произведение давления на объем, деленное на абсолютную температуру остается величинойпостоянной:
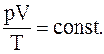
5.Уравнение Менделеева-Клапейрона для произвольной массы газа:
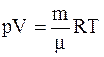 .
.
Для одного моля идеального газа основное уравнение Менделеева-Клапейрона имеет вид
pV=RT.
Закон Дальтона:
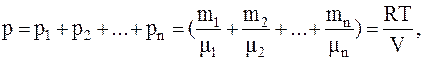
т.е. полное давление смеси газов равно сумме парциальных давлений всех газов, входящих в смесь.
Основным уравнением молекулярно-кинетической теории называют одно из выражений:
pV= 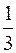 Nm<v>2,
Nm<v>2,
p= 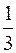 nom<v2>,
nom<v2>,
p= 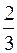 no<Ek>,
no<Ek>,
где <Ek>= 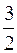 kT – средняя кинетическая энергия поступательного движения молекул газа.
kT – средняя кинетическая энергия поступательного движения молекул газа.
Число независимых координат,необходимых для полного описания положения системы в пространстве, называется числом степеней свободы–i.
Общее число степеней свободы равно:
i=iп+iвр+iк,
где iп – число степеней свободы поступательного движения точки;
iвр – число степеней свободы вращательного движения точки;
iк – число степеней свободы колебательного движения точки.
Одноатомная молекула газа имеет только три степени свободы (i=3); двухатомная – при упругой связи – шесть степеней свободы (i=6), а при жёсткой связи – пять степеней свободы (i=5); трёхатомная молекула при жёсткой связи между атомами имеет шесть степеней свободы (i=6).
Поступательное движение описывается тремя степенями свободы, а т.к. все степени свободы равноправны, то на каждую изних приходится в среднем энергия, равная
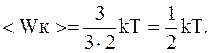
Молекула, имеющая i степеней свободы, обладает в среднем энергией
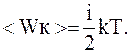
где i=iп+iвр+iк.
Дата добавления: 2014-12-30; просмотров: 1008;
