Скорость реакции увеличивается с увеличением темпера-
Железо при обычной температуре реагирует с хлором очень медленно, при высокой же температуре протекает бурная реакция (железо горит в хлоре):
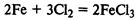
Водород восстанавливает оксиды металлов при нагревании, при комнатной температуре эта реакция не идет, то есть ее скорость равна 0:
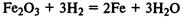
Скорость многих реакций увеличивается в присутствии специальных веществ — катализаторов.
Катализаторы увеличивают скорость реакции, но по окончании реакции остаются неизменными.
Примеры каталитических реакций:
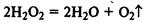
(реакция сильно ускоряется в присутствии МnО2).
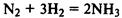
(реакция протекает только в присутствии катализаторов — платины, оксида ванадия (V), железа и др).
Общая характеристика металлов главных подгрупп I – III групп (I-A – III-A групп) в связи с их положением в периодической системе химических элементов Д. И. Менделеева и особенности строение их атомов, металлическая химическая связь, химические свойства металлов как восстановителей.
В периодической системе элементов металлы в основном располагаются в главных подгруппах I—Ill групп, а также в побочных подгруппах.
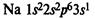
В IA группе у атомов элементов на внешнем энергетическом уровне находится 1 электрон в состоянии s1, во IIA группе у атомов на внешнем ЭУ 2 электрона в состоянии s2. Эти элементы относятся к s-элементам. В IIIA группе у всех элементов на внешнем ЭУ 3 электрона в состоянии s2p1. Они относятся к p-элементам.
В IA группу входят щелочные металлы Li, Na, K, Rb, Cs, Fr, активность которых при движении сверху вниз увеличивается вследствие увеличения радиуса атомов, металлические свойства возрастают также, как и у щелочеземельных металлов IIA группы Be, Mg, Ca, Sr, Ba, Ra и металлов IIIA группы Al, Ga, In, Tl.
Оксиды типа R2O характерны только для Li, для всех остальных щелочных металлов характерны пероксиды R2O2, которые являются сильными окислителями.
Все металлы этих групп образуют основные оксиды и гидроксиды, кроме Be и Al, которые проявляют амфотерные свойства.
Химические свойства. Атомы металлов имеют больший радиус, чем атомы неметаллов, поэтому легко теряют валентные электроны. Вследствие этого металлы проявляют восстановительные свойства.
Дата добавления: 2015-04-05; просмотров: 1443;
