Круговой процесс (цикл). Прямой и обратный цикл.
| Круговой процесс (цикл) – процесс, в котором ТС, претерпев ряд изменений, возвращается в исходное состояние (рис.3). → Прямой цикл – цикл тепловых двигателей, идущий в pV-координатах по часовой стрелке (линия расширения выше линии сжатия). Обратный цикл – цикл холодильных установок и машин-орудий, идущий в pV-координатах против часовой стрелки (линия расширения лежит ниже линии сжатия). 1.1.6. Обратимые и необратимые процессы. Процессы могут быть обратимыми и необратимыми. Обратимый процесс это процесс, при котором ТС, пройдя ряд состояний, может вернуться в начальное состояние через те же промежуточные состояния, при этом источники тепла и аккумулятор работы тоже придут в своё начальное состояние. | 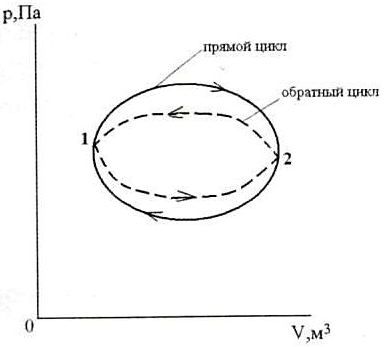
|
Таким образом, при реализации процесса в прямом и обратном направлении в ТС и окружающей среде не остаётся никаких изменений. Условия для осуществления обратимого процесса:
1. Процесс должен протекать бесконечно медленно (квазистатически). Таким образом, только равновесные процессы могут быть обратимыми.
2. Должно соблюдаться механическое равновесие, т.е. бесконечно малая разность давлений dp у рабочего тела, изменяющего своё состояние, и у внешней среды.
3. Должно соблюдаться термическое равновесие, т.е. бесконечно малая разность температур у рабочего тела и внешней среды.
4. Необходимо отсутствие трения, излучения и прочих реальных потерь.
Таким образом, обратимый процесс – это идеальный процесс, неосуществимый в действительности. Однако это не уменьшает теоретического значения понятия обратимости как вспомогательного средства анализа. Рассмотрение равновесных и обратимых ТД-процессов позволяет при некоторой идеализации изучать реальные явления с применением относительно простого мат. аппарата.
Все реальные процессы – например, переход тепла от горячего тела к холодному, смешение газов, превращение тепла в работу, течение газов с трением – являются неравновесными и необратимыми и могут рассматриваться как равновесные и обратимые только в рамках определённых допущений. Классическая термодинамика рассматривает только равновесные и обратимые процессы.
1.1.9. Теплоёмкость газов. Зависимость теплоёмкости от температуры и процесса. Истинная и средняя теплоёмкость.
В термодинамике значительную роль играет понятие теплоёмкости газа. Рассмотрим процесс AB, в котором при сообщении 1 кг газа теплоты q его температура возрастает от T1 до T2. Отношение теплоты q к изменению температуры T2- T1 называется теплоёмкостью газа: (рис.4) → → → → → →
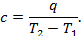 Как видно, теплоёмкость это количество теплоты, необходимое для повышения температуры 1 кг газа на 1оС. Теплоёмкость газа есть переменная
Как видно, теплоёмкость это количество теплоты, необходимое для повышения температуры 1 кг газа на 1оС. Теплоёмкость газа есть переменная
| 
|
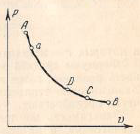
величина, если её определять на различных участках AB, AC, AD процесса AB, то 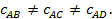 Это показывает, что на отдельных участках процесса, на которых температура изменяется на 1оС, расходуются различные количества теплоты. Поэтому приведённая выше формула не определяет действительный удельный расход теплоты, а показывает лишь, сколько теплоты в среднем в процессе AB сообщается при нагревании газа на 1оС.
Это показывает, что на отдельных участках процесса, на которых температура изменяется на 1оС, расходуются различные количества теплоты. Поэтому приведённая выше формула не определяет действительный удельный расход теплоты, а показывает лишь, сколько теплоты в среднем в процессе AB сообщается при нагревании газа на 1оС.
Средняя теплоёмкость – отношение теплоты, сообщаемой газу, к изменению его температуры при условии, что разность температур является конечной величиной. Под истинной теплоёмкостью газа понимают предел, к которому стремится средняя теплоёмкость при стремлении ΔT к нулю. Так, если в процессе Aa средняя теплоёмкость 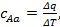 то истинная теплоёмкость при начальном состоянии A:
то истинная теплоёмкость при начальном состоянии A:
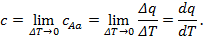
Следовательно, истинной теплоёмкостью называется отношение теплоты, сообщаемой газу в процессе, к изменению его температуры при условии, что разность температур исчезающее мала.
Общие формулы теплоты. Из приведённых выше формул следует, что теплоту, сообщаемую газу в произвольном процессе, можно определить по формуле:
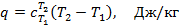
или для произвольного количества газа
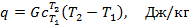
где 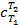 – средняя теплоёмкость газа в рассматриваемом процессе при измене6нии его температуры от T1 до T2. Теплоту можно определить также по формулам:
– средняя теплоёмкость газа в рассматриваемом процессе при измене6нии его температуры от T1 до T2. Теплоту можно определить также по формулам:
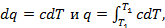 где c – истинная теплоёмкость газа.
где c – истинная теплоёмкость газа.
Формулы средней и истинной теплоёмкости. Теплоёмкость реальных газов зависит от давления и температуры. Зависимостью от давления часто пренебрегают. Зависимость от температуры значительна и на основании экспериментальных данных выражается уравнением вида 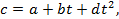 где a, b, d – числовые коэффициенты, зависящие от природы газа и характера процесса.
где a, b, d – числовые коэффициенты, зависящие от природы газа и характера процесса.
Удельные теплоёмкости:
Теплоёмкость, отнесённая к 1 кг газа, называется весовой теплоёмкостью – 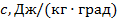 . Теплоёмкость, отнесённая к 1 м3 газа, называется объёмной теплоёмкостью –
. Теплоёмкость, отнесённая к 1 м3 газа, называется объёмной теплоёмкостью – 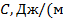 3
3 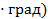 . Теплоёмкость, отнесённая к 1 молю газа, называется мольной теплоёмкостью –
. Теплоёмкость, отнесённая к 1 молю газа, называется мольной теплоёмкостью – 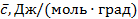 .
.
Пусть для нагревания 1 кг газа на 1оС необходимо 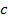 джоулей тепла. Т.к. в моле содержится
джоулей тепла. Т.к. в моле содержится 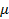 килограмм газа, то для нагревания 1 моля на 1оС необходимо в
килограмм газа, то для нагревания 1 моля на 1оС необходимо в 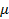 раз больше тепла, т.е.
раз больше тепла, т.е.
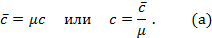
Теперь для нагревания 1 м3 газа на 1оС необходимо 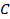 джоулей тепла. Т.к. в моле при нормальных условиях содержится 22,4 м3 газа, то для нагревания 1 моля на 1о необходимо в 22,4 раза больше, тепла:
джоулей тепла. Т.к. в моле при нормальных условиях содержится 22,4 м3 газа, то для нагревания 1 моля на 1о необходимо в 22,4 раза больше, тепла:
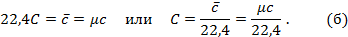
Сравнивая формулы (а) и (б), найдём зависимость между весовой и объёмной теплоёмкостями:
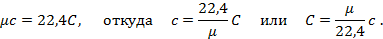
Зависимость теплоёмкости от характера процесса. Рассмотрим два процесса подвода тепла к газу:
а) Тепло подводится к 1 кг газа, заключённому в цилиндр с неподвижным поршнем (рис.5). Тепло, сообщённое газу, будет равно 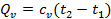 , где
, где 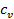 – теплоёмкость газа при
– теплоёмкость газа при 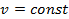 ;
; 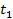 и
и 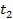 – начальная и конечная температуры газа
– начальная и конечная температуры газа 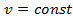 . При разнице температур
. При разнице температур 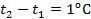 получим, что
получим, что 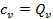 . Очевидно, что всё тепло в этом случае пойдёт на увеличение внутренней энергии газа.
. Очевидно, что всё тепло в этом случае пойдёт на увеличение внутренней энергии газа.
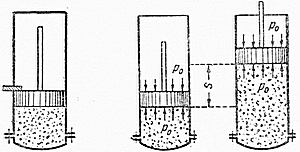
Рис. 5. Рис. 6.
б) Тепло подводится к 1 кг газа, заключённому в цилиндр с подвижным поршнем (рис.6) и, в этом случае, будет равно 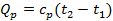 , где
, где 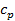 – теплоёмкость газа при
– теплоёмкость газа при 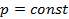 ;
; 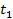 и
и 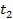 – начальная и конечная температуры газа при
– начальная и конечная температуры газа при 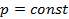 . При
. При 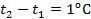 получим, что
получим, что 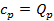 . В этом случае подведённое к газу тепло пошло на на увеличение внутренней энергии газа (как и в первом случае), а также на совершение работы при движении поршня. Следовательно, для повышения температуры 1 кг газа на 1оС во втором случае необходимо больше теплоты, чем в первом, т.е.
. В этом случае подведённое к газу тепло пошло на на увеличение внутренней энергии газа (как и в первом случае), а также на совершение работы при движении поршня. Следовательно, для повышения температуры 1 кг газа на 1оС во втором случае необходимо больше теплоты, чем в первом, т.е. 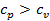 .
.
Рассматривая другие процессы, можно установить, что теплоёмкость может принимать самые разные числовые значения, т.к. количество теплоты, сообщаемое газу, зависит от характера процесса.
Связь между 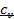 и
и 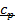 , коэффициент
, коэффициент 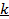 . При нагревании 1 кг газа на 1оС при
. При нагревании 1 кг газа на 1оС при 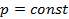 подводится
подводится 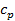 Дж тепла. Часть его, равная
Дж тепла. Часть его, равная 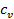 , идёт на увеличение внутренней энергии, а часть – на совершение работы расширения. Обозначим эту работу через
, идёт на увеличение внутренней энергии, а часть – на совершение работы расширения. Обозначим эту работу через 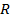 . Т.к. теплота, затраченная на нагревание газа и совершение работы, должна быть в сумме равна подведённой теплоте, то можно записать, что
. Т.к. теплота, затраченная на нагревание газа и совершение работы, должна быть в сумме равна подведённой теплоте, то можно записать, что
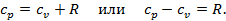
Можно показать, что величина 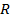 есть газовая постоянна в уравнении состояния газа
есть газовая постоянна в уравнении состояния газа 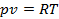 .
.
В термодинамике часто используется отношение теплоёмкости при постоянном давлении к теплоёмкости при постоянном объёме
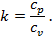
Для идеальных газов 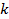 – величина постоянная и зависит от природы газа (от его атомности). В таблице приведены теоретические значения теплоёмкостей согласно молекулярно-кинетической теории.
– величина постоянная и зависит от природы газа (от его атомности). В таблице приведены теоретические значения теплоёмкостей согласно молекулярно-кинетической теории.
| Число атомов в молекуле | 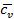
| 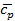
| 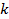
|
| 2,98 | 4,96 | 1,67 | |
| 4,97 | 6,97 | 1,4 | |
| 5,96 | 7,96 | 1,33 |
Лекция 3. Первый закон термодинамики (всё тот же)
Дата добавления: 2017-03-29; просмотров: 1048;
