ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ. РАБОТА И ТЕПЛОТА.
Закон сохранения и превращения энергии является наиболее общим универсальным законом природы, применяемым ко всем явлениям и процессам.
Этот закон формулируется так:
Энергия изолированной системы, при любых происходящих в ней процессах, не меняется; энергия не уничтожается и не создается.
Первый закон термодинамики является частным случаем этого закона применительно к процессам, протекающим в термодинамических системах.
В соответствии с первым законом термодинамики внутренняя энергия термодинамической системы может изменяться лишь в результате энергетического обмена с окружающей средой.
В термодинамике первое начало обычно записывают так (применительно к 1кг массы):
q = Δu + l (2.6)
или в дифференциальной форме:
dq = du +dl. (2.7)
Таким образом, в общем случае тепло, подводимое к системе, расходуется как на изменение энергии, так и на совершение работы.
Работа 1 кг газа в элементарном равновесном процессе:
dl = pdv. (2.8)
Для конечного процесса:
l = 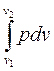 . (2.9)
. (2.9)
Чтобы решить интеграл (2.9), надо знать зависимость, связывающую давление и объем в ходе процесса. Таким образом, работа, производимая газом, в отличие от параметров состояния, зависит от вида процесса.
2.4. СВОЙСТВА рv – и Тs – ДИАГРАММ
Если воспользоваться системой координат рv, то величину работы можно определить графически.
Нетрудно видеть (рис. 2.1), что элементарная площадка аbcd = рdv = dl, а площадь АВСD = 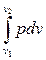 = l. Таким образом, в системе координат рv работа, приведенная в ходе процесса численно равна площади, ограниченной кривой процесса, осью абсцисс и крайними ординатами.
= l. Таким образом, в системе координат рv работа, приведенная в ходе процесса численно равна площади, ограниченной кривой процесса, осью абсцисс и крайними ординатами.
Из-за этого свойства рv- диаграмму называют иногда рабочей диаграммой.
Теплота, подведенная (отведенная) в ходе элементарного обратимого процесса может быть, в частности, вычислена при использовании уравнений (2.4) и (2.5)
dQ = TdS или dq = Tds. (2.10)
Для всего процесса
Q = 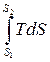 или q =
или q = 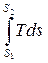 . (2.11)
. (2.11)
Взаимосвязь между Т и S в разных процессах различна. Поэтому количество теплоты (как и работы) зависит не только от начального и конечного состояний системы, но и от вида процесса.
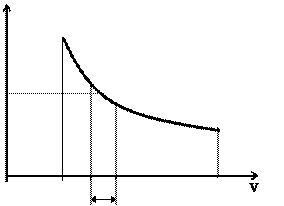
Решение интегралов (2.11) можно осуществить графическим путем, если воспользоваться диаграммой Тs. Нетрудно видеть (рис. 2.2), что элементарная площадка аbcd = Tds = dq, a площадь АВСD = 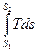 = q.
= q.
Таким образом, в системе координат Тs площадь, ограниченная кривой процесса, осью абсцисс и крайними ординатами численно равна подведенной (отведенной) теплоте. Поэтому Тs- диаграмму иначе называют тепловой.
Следует добавить, что по изменению энтропии в обратимых процессах можно сделать вывод, о направлении теплообмена.
Как следует из уравнений (2.10) знак dq и знак ds совпадают, т.к. абсолютная температура сугубо положительная величина.
Если рассмотреть совместно уравнения (2.7), (2.8) и (2.10), то уравнение первого начала может быть приведено к виду
Тds = du + pdv. (2.12)
|
 | |||
 | |||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 2.1. Рис. 2.2.
Лекция 4
Дата добавления: 2019-04-03; просмотров: 528;
