Потенциал разложения LiCl и КСl
| Температура, °С | Потенциал разложения, в | |
| KCl | LiCl | |
| 3,893 | 3,785 | |
| 3,450 | 3,498 | |
| 3,210 | 3,212 |
Металлический литий также частично растворяется в расплаве. При 650° С в расплаве LiCl растворяется до 1,2 ат. % Li. С повышением температуры растворимость лития увеличивается. Учитывая сближение значений потенциалов разложения LiCl и КСl и увеличение растворимости с повышением температуры, необходимо проводить электролиз при пониженной температуре.
При соблюдении условий, определяемых как свойствами электролита, так и конструкцией ванны, можно снизить переход калия в катодный осадок. Натрий всегда выделяется на катоде совместно с литием, поэтому необходима предварительная очистка исходных солей.
Достаточно стойкими материалами для футеровки ванны электролизера оказались алунд и тальк, предварительно обожженный при 800-900° С. Возможна футеровка ванны особо плотным графитом. В качестве анода обычно используют графитовый стержень, вводимый в ванну сверху или снизу (через дно). Катодом служит железный стержень или решетка. Обычно электролизер представляет собой железную или чугунную ванну, выложенную изнутри плитами материала, стойкого в среде расплава LiCl-КСl. Катодное пространство отделяется от анодного тальковой или алундовой перегородкой, погруженной в расплав на 2-3 см. Для защиты расплавленного лития от действия воздуха катодное пространство плотно закрывают асбестовой крышкой. Возможно выполнение корпуса ванны из огнеупорного кирпича. В крышке ванны должны быть предусмотрены отверстия для загрузки солей, вычерпывания металла и удаления хлора (с местным отсосом).
По одному из вариантов конструкции ванны катодом служил железный стержень, пропущенный сквозь дно ванны. Над катодом подвешивался специальный приемник, имеющий форму цилиндра. Образующийся металл всплывает. Плотность металлического лития и его вязкость изменяются с температурой следующим образом:
| Температура, °С | 183,4 | 192,3 | 208,1 | 250,8 | 285,5 |
| Плотность, г/см3 | 0,5115 | 0,5106 | 0,5092 | 0,5053 | 0,5020 |
| Вязкость, мпз | 5,918 | 5,749 | 5,541 | 4,917 | 4,548 |
Всплывший металл собирается в приемнике в слое специального нефтяного масла, имеющего высокую точку кипения.
Расплавленный литий вычерпывается из ванны через отверстие ситчатыми ложками через определенное время. Возможность этой операции обусловлена большим поверхностным натяжением расплавленного металла по сравнению с расплавом солей. При этом расплав LiCl-КСl не задерживается на сите» отделяясь от металла и стекая обратно в электролизер. По мере вычерпывания лития в анодное пространство вводится соответствующее количество безводного LiCl, предварительно расплавленного и выдержанного в течение 6-7 ч для отстаивания нерастворимых примесей.
Примерные параметры ванны суточной производительностью 20 кг лития:
| Ток, а | |
| Плотность тока, а/см2: | |
| - катодная | 4-5 |
| - анодная | 0,8-1,0 |
| Выход по току, % | |
| Расход электроэнергии, квт.ч/кг | |
| Напряжение на ванне, в |
Существуют ванны производительностью до 40 кг металла в сутки. Получаемый черновой металл переплавляется в вазелиновом масле и имеет состав: более 90% Li, 0,3-1 % К, до 2,5% Na и Mg, 0,04% Fe, 0,8% Si. Магний и кремний попадают в металл из футеровки.
Схема ванны для электролиза расплава LiCl-КСl представлена на рис. 77. Угольная футеровка ванны позволяет улучшить качество получаемого лития.
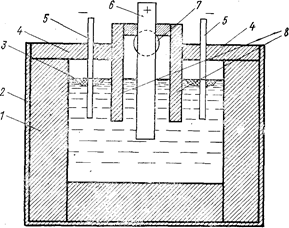
Рис. 77. Схема ванны на 800 a (Каплан Г. Е., Силина Г. Ф., Остроушко Ю. И., 1963, с. 111, рис. 17):
1-тальковая футеровка; 2-кожух ванны; 3 - жидкий литий; 4 - крышка катодного пространства; 5 - стальные катоды; 6 - графитовый анод; 7 - отверстие для удаления хлора из анодной ячейки; 8- тальковая диафрагма.
Для получения лития, не содержащего калия, предложено проводить электролиз смеси 85-90% LiBr и 15-10% LiCl. Полученный таким способом литий отличался высокой чистотой. Электролизу фактически подвергался LiBr - соль дорогая, что делает данный процесс нерентабельным.
Делались попытки осуществить электролиз растворов солей лития в неводных растворителях: раствора безводного LiCl в пиридине (при 20° С растворимость LiCl в пиридине 11,8%), в ацетоне (на медном катоде), в нитробензоле (в систему для повышения растворимости LiCl добавляли АlСl3). Однако до настоящего времени единственным промышленным способом является электролиз расплава LiCl-КСl.
Установлено, что выход по току определяется температурой расплава LiCl-КСl, что, очевидно, связано с образованием на катоде субхлорида Li2Cl.
В процессе электролиза электролит постепенно загрязняется продуктами разрушения анода и футеровки ванны, которые накапливаются на дне в виде шлама. Скопившийся шлам периодически удаляют и заменяют часть электролита свежим. Удаленный электролит растворяют в воде, раствор отфильтровывают от частиц шлама, нейтрализуют LiOH, образующуюся за счет захвата удаленным расплавом частиц металлического лития. Нейтрализация производится соляной кислотой. Полученный раствор упаривают досуха и повторно используют получающуюся смесь LiCl-КСl для электролиза.
Возможно получение электролитическим способом сплавов лития. Используя в качестве катода расплавы металлов (А1, Zn, Pbi) или сплавов Сu-Аl, можно в результате электролиза смеси LiCl-КСl получить сплавы лития. Электролиз в этом случае проводят при температуре 550-750°С (в зависимости от материала катода). Напряжение 5 в. В этом процессе можно использовать электролизеры, сконструированные для электролиза с ртутным катодом.
Возможно соль легируемого литием металла вводить непосредственно в электролит, при этом на катоде выделяется сплав. Такую технику используют для получения сплавов лития с легкими легкоплавкими металлами. Электролизеры в этом случае подобны электролизерам для получения чистого лития. Так были получены электролизом смеси хлоридов сплавы Li-Са и Li-Са-Na.
Чтобы получить сплавы лития с тяжелыми тугоплавкими металлами (Со, Ni и др.), в ванну LiCl-КСl кроме основных графитовых анодов помещают также дополнительные растворимые аноды из легируемого металла. При этом потенциал катода должен быть таким, чтобы обеспечивалось выделение наиболее электроотрицательного элемента получаемого сплава,
Дата добавления: 2019-04-03; просмотров: 715;
