Корпускулярно-волновой дуализм
Основные понятия химии
Химия - наука о составе, строении, свойствах и превращениях веществ. Известны вещества: органические (>10 млн.) и неорганические (>150 тыс.).
В настоящее время известно, что все органические и часть (10-20%) неорганических веществ имеют молекулярное строение, то есть, состоят из молекул. В то же время большинство неорганических веществ (металлы, соли и др.) имеют немолекулярное строение и состоят из атомов, ионов. Например, метан и этанол состоят из молекул, железо состоит из атомов, ионов и электронов, хлорид натрия состоит из ионов. Поэтому можно заключить, что вещества состоят из химических частиц (молекул, атомов, ионов), которые имеют сложное строение и состоят из элементарных частиц (протонов, нейтронов, электронов).
Атом - нейтральная частица, состоящая из положительного ядра и электронов.
Молекула - наименьшая частица вещества, сохраняющая его химические свойства; молекула - устойчивая группа атомов, связанных химическими связями.
Химический элемент - вид атомов с одинаковым зарядом ядра. Элемент обозначают 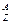 X, где X - символ элемента, Z - порядковый номер элемента, А - массовое число. Порядковый номер Z равен заряду ядра атома, числу протонов в ядре атома и числу электронов в атоме. Массовое число А равно сумме чисел протонов и нейтронов в атоме. Число нейтронов равно разности А-Z. Например, в атоме
X, где X - символ элемента, Z - порядковый номер элемента, А - массовое число. Порядковый номер Z равен заряду ядра атома, числу протонов в ядре атома и числу электронов в атоме. Массовое число А равно сумме чисел протонов и нейтронов в атоме. Число нейтронов равно разности А-Z. Например, в атоме 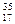 Cl имеется 17 протонов, 17 электронов и 18 нейтронов, а в атоме
Cl имеется 17 протонов, 17 электронов и 18 нейтронов, а в атоме 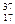 Cl имеется 17 протонов, 17 электронов и 20 нейтронов.
Cl имеется 17 протонов, 17 электронов и 20 нейтронов.
Изотопы - атомы одного элемента, имеющие разные массовые числа. Изотопы имеют одинаковые числа протонов и электронов и разные числа нейтронов. Например, атомы 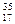 Cl и
Cl и 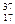 Cl.
Cl.
Относительная атомная масса (Аr) - отношение средней массы атома естественного изотопического состава элемента к 1/12 массы атома изотопа углерода 12С. Атомная масса - среднее значение массовых чисел изотопов. Например, природный хлор состоит на 75% из 35Cl и на 25% из 37Cl. Поэтому Аr(Cl) = 0,75×35 + 0,25×37 = 35,5 а.е.м.
Относительная молекулярная масса (Мr) - отношение средней массы молекулы естественного изотопического состава вещества к 1/12 массы атома изотопа углерода 12С. Относительная молекулярная масса молекулы может быть вычислена как сумма относительных масс атомов, составляющих эту молекулу.
Мr(H2O) = 2Ar(H) + Ar(O) = 18 а.е.м.
Моль - это количество вещества, содержащее столько структурных единиц (атомов, молекул, ионов), сколько содержится атомов в 0,012 кг изотопа углерода 12С. Моль - это количество вещества, содержащее 6,02×1023 структурных единиц (атомов, молекул, ионов).
Число Авогадро NА = 6,02×1023 частиц/моль.
n = N/NA, где n - количество вещества (моль), N - число частиц, а NА - число Авогадро.
Молярная масса М (г/моль) - отношение массы вещества m (г) к количеству вещества n (моль).
Молярная масса численно равна массе одного моля вещества.
М = m/n, откуда имеем: m = M×n и n = m/M.
Молярный объем газа VМ (л/моль) - это отношение объема газа V (л) к количеству вещества этого газа n (моль).
Молярный объем газа численно равен объему одного моля. При нормальных условиях (t = 0оC или Т = 273 К и p = 101325 Па = 760 мм.рт.ст.) один моль любого газа занимает объем 22,4 л, и
VМ = 22,4 л/моль.
VМ = V/n, откуда имеем: V = VM×n и n = V/VM.
| Имеем общую формулу: | n = m/M =V/VM = N/NA |
Эквивалент- реальная или условная частица, взаимодействующая с одним атомом водорода, или замещающая его, или эквивалентная ему каким-либо другим способом.
Молярная масса эквивалентов МЭ - отношение массы вещества к количеству эквивалентов этого вещества:
МЭ = m/n (экв).
В реакциях обмена зарядов молярная масса эквивалентов вещества А 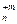 В
В 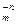 с молярной массой М равна: МЭ = М/(n´m).
с молярной массой М равна: МЭ = М/(n´m).
В окислительно-восстановительных реакциях молярная масса эквивалентов вещества с молярной массой М равна:
МЭ = М/n(е), где п - число переданных электронов.
Закон эквивалентов - массы реагирующих веществ пропорциональны молярным массам их эквивалентов.
m1/m2 = MЭ1/МЭ2 или n1 = n2.
Для растворов закон эквивалентов может быть записан в следующем виде: CN1×V1 = CN2×V2 ,
где m1 и m2 - массы двух веществ, МЭ1 и МЭ2 - молярные массы эквивалентов, n1 и n2 - количества эквивалентов этих веществ, CN1, CN2 и V1 и V2 - нормальные концентрации и объёмы растворов этих двух веществ.
Объединенный газовый закон. pV = nRT, где имеем:
р - давление (Па, кПа), V - объем (м3, л), n - количество вещества газа (моль), Т - температура (К), T(K) = t(oC) + 273, R - константа,
R = 8,314 Дж/(К×моль), при этом Дж = Па×м3 = кПа×л.
Строение атома
Корпускулярно-волновой дуализм
Атом - нейтральная частица, состоящая из положительного ядра и электронов. Химические свойства веществ определяются строением составляющих их атомов.
Резерфорд, пропуская поток a-частиц (ядер атома гелия He2+) через тонкий слой металла, обнаружил, что большая часть a-частиц проходит через металл, а меньшая часть - отклоняется. Резерфорд предложил планетарную модель атома: атом состоит из небольшого массивного и положительно заряженного ядра и электронов, которые вращаются вокруг ядра как планеты вокруг Солнца. Радиус ядра равен 10-14-10-15 м, а радиус атома 10-10 м.
По законам классической физики такой атом должен быть неустойчивым - электроны, вращаясь вокруг ядра, должны отдавать энергию и падать на ядро. Однако, атом стабилен. Значит, классическая физика неверно описывает свойства атомов. Почему?
Классическая физика различает и противопоставляет:
1. Физические тела, имеющие корпускулярные свойства. Например, мяч, автомобиль, Земля и т.д. имеют массу, скорость, траекторию движения, энергию и пр. и подчиняются законам механики Ньютона.
2. Излучения, имеющие волновые свойства. Например, свет характеризуется длиной волны, периодом, частотой колебаний, интерференцией, дифракцией и пр. Излучения описываются законами электромагнетизма Максвелла.
Экспериментальные факты указывают на неправомерность подобного разделения.
Эйнштейн (1905 г.) объяснил фотоэлектрический эффект, предположив, что свет состоит из частиц - фотонов, имеющих определенную энергию Е=hn , где E - энергия фотона, h - константа Планка, h=6.625´10-34 Дж´сек., n - частота колебания излучения. Таким образом, Эйнштейн допустил, что свет может проявлять не только волновые, но и корпускулярные свойства.
Девиссон и Джермер (1927 г.) обнаружили дифракцию электронов, доказав, что электроны (т.е. частицы) могут иметь волновые свойства.
Вопреки положениям классической физики экспериментальные факты указывают на корпускулярно-волновой дуализм материи, который состоит в том, что корпускулярные и волновые свойства не исключают друг друга. Каждый объект может иметь и волновые, и корпускулярные свойства.
Луи де Бройль (1924 г.) предложил формулу, связывающую волновые и корпускулярные свойства объектов: l = h/(mV) и означающую, что волна с длиной волны l соответствует каждому телу с массой m и скоростью V. Для света эта формула может быть выведена их уравнений Планка E=hn=hc/l и Эйнштейна E=mc2. Откуда имеем: hc/l=mc2 или l=h/(mc), где с - скорость света. Поскольку атомы имеют размеры 10-10 м, то мы можем наблюдать и фиксировать волны с длинами волн более 10-10 м. Принимая скорость движения частицы V=1000 м/с, определим массу частицы, для которой возможно наблюдение волновых свойств, по формуле l=h/mV>10-10. Имеем: m<h/(V×10-10) и m<6.625´10-27кг. Отсюда следует, что, хотя волновые свойства существуют для всех объектов, но наблюдаться они могут лишь для микрообъектов, имеющих массы порядка массы атома и электрона.
Свойства материи характеризуются также принципом неопределенности Гейзенберга: D(mVx) > h/2p или DVx×Dx>h/(2pm), где m - масса частицы, x - ее координата, Vx - скорость в направлении x, а D - неопределенность, погрешность определения. Принцип неопределенности означает, что нельзя одновременно сколь угодно точно указать положение (координату x) и количество движения (mVx) частицы. Произведение неопределенностей координаты и скорости частицы всегда больше, чем h/2pm. При этом, очевидно, что для объектов с большими массами m>>h/2p координата и скорость определяются достаточно точно, а для микрообъектов с массами того же порядка, что h/2p, координата и скорость не могут быть определены сколь угодно точно одновременно, и для микрообъектов нельзя указать траекторию их движения.
Частицы с маленькими массами (атомы, ядра, электроны, молекулы) не являются частицами в понимании этого механикой Ньютона и не могут изучаться классической физикой. Они изучаются квантовой физикой. Согласно постулатам квантовой физики все свойства атомов (электронов) описываются волновой функцией, которую можно найти, решив волновое уравнение. Квадрат модуля волновой функции имеет смысл плотности вероятности нахождения частиц в данной точке пространства. Волновая функция зависит от целочисленных параметров - квантовых чисел - n, l, ml и ms. С их помощью мы будем изучать строение атома.
Квантовые числа
Главное квантовое число - n - принимает значения 1, 2, 3, 4, 5, 6 и 7, соответствующие электронным уровням (слоям) K, L, M, N, O, P и Q.
Уровень - пространство, где расположены электроны с одинаковым числом n. Электроны разных уровней пространственно и энергетически отделены друг от друга, поскольку число n определяет энергию электронов Е (чем больше n, тем больше Е): E(n=1)<E(n=2)<... и расстояние R между электронами и ядром (чем больше n, тем больше R): R(n=1)<R(n=2)<...
Орбитальное (побочное, азимутальное) квантовое число - l. Число l - принимает значения в зависимости от числа n:
l = 0, 1,...(n-1). Например, если n = 2, то l = 0, 1; если n = 3,
то l = 0, 1, 2. Число l характеризует подуровень (подслой).
Подуровень (часть уровня) - пространство, где расположены электроны с определенными числами n и l. Число подуровней равно номеру уровня: первый уровень содержит один подуровень, второй - два и т.д. Подуровни данного уровня обозначаются в зависимости от числа l: s - если l=0, p - если l=1, d - если l=2, f - если l=3. Подуровни данного атома обозначаются в зависимости от чисел n и l, например, 2s (n=2, l=0), 2p (n=2, l=1), 3d (n=3, l=2), 5f (n=5, l=3) и т.д. Подуровни данного уровня имеют разную энергию (чем больше l, тем больше E): Es <Ep <Ed<... и разную форму орбиталей, составляющих эти подуровни: s-орбиталь имеет форму шара, p-орбиталь имеет форму гантели и т.д.
По законам квантовой физики мы можем указать не траекторию движения электрона, а место его наиболее вероятного нахождения. Поверхности, определяющие форму орбиталей, ограничивают пространство, в котором вероятность нахождения электрона составляет около 95%.
Магнитное квантовое число - ml - характеризует ориентацию орбитального магнитного момента, равного l, в пространстве относительно внешнего магнитного поля и принимает значения:
-l,...-1, 0, 1,...l, т.е. всего (2l + 1) значение. Например, если l = 2, то
ml = -2, -1, 0, 1, 2.
Орбиталь (часть подуровня) - это пространство, где расположены электроны (не более двух) с определенными числами n, l, ml. Подуровень содержит 2l+1 орбиталь. Например, d-подуровень содержит 5 d-орбиталей. Орбитали одного подуровня, имеющие разные числа ml, имеют одинаковую энергию.
Магнитное спиновое число - ms - характеризует ориентацию собственного магнитного момента электрона s, равного 1/2, относительно внешнего магнитного поля и принимает два значению: +1/2 и -1/2.
Дата добавления: 2018-11-25; просмотров: 869;
