Окислительно-восстановительные реакции в титриметрии
ОВР, основой которых является обмен электронами, протекают между двумя редокс-парами.
Условно ОВ реакции относятся к 3-му типу и в общем виде они записываются:
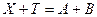
При рассмотрении вопроса о возможности их использования в титриметрии необходимо дать ответ на следующие вопросы:
1) протекают ли реакция между данным окислителем и восстановителем?
Ответ на этот вопрос дается путем сравнения табличных значений нормальных редокс-потенциалов окислителя и восстановителя;
2) имеется ли скачок на кривой титрования, т.е. DЕ0 > 0, где DЕ0 = Е0ок - Е0восс
Титрование по методу окисления – восстановления возможно если DЕ0 > 0,4 В.Только в этом случае обеспечивается необходимая полнота и скорость реакции.
Кроме того, о наличии скачка титрования конкретной ОВ реакции судят по значению ее константы равновесия.
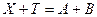
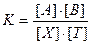
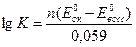 Существует связь между константой равновесия редокс-реакции К и разностью нормальных редокс-потенциалов DЕ0. Величину К вычисляют, исходя из ЭДС полной реакции
Существует связь между константой равновесия редокс-реакции К и разностью нормальных редокс-потенциалов DЕ0. Величину К вычисляют, исходя из ЭДС полной реакции 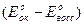
где n-число электронов, переходящих в процессе стехиометрической реакции.
Титрантами в ОВ титровании служат растворы окислителя и восстановителя. Если раствор восстановителя титруется стандартным раствором окислителя то метод называют «оксидиметрия», если же раствор окислителя титруется стандартным раствором восстановителя то метод называют «редуктометрия» В зависимости от условий окислитель и восстановитель могут вступать в реакции, в которых участвует разное количество электронов. Поэтому часто титранты не имеют постоянного эквивалента. Например, в кислой среде ион MnO4¯ присоединяет 5 электронов, в щелочной - 1, в нейтральной - 3. Поэтому в кислой среде молярная масса эквивалента М( 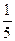 KMnO4) = 158,04/5 = 31,6 г/моль, в щелочной среде М(KMnO4) = 158,04; в нейтральной - М(
KMnO4) = 158,04/5 = 31,6 г/моль, в щелочной среде М(KMnO4) = 158,04; в нейтральной - М( 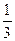 KMnO4) = 158,04/3 = 52,68 г/моль.
KMnO4) = 158,04/3 = 52,68 г/моль.
Методы ОВ титрования называют по типу применяемого титранта. Наиболее широкое применение нашли следующие виды ОВ титрования: перманганатометрия – титрант KMnO4, йодометрическое - титранты растворы йода (J2) и тиосульфата натрия (Na2S2O3), броматометрическое (титрант КBrO3), бромометрическое (титрант Br2 (КBrO3 + KBr), дихроматометрическое (K2Cr2O7), церийметрическое - Се(SO4)2 и др.
Дата добавления: 2017-11-04; просмотров: 785;
