Оценка окислительно-восстановительной способности вещества.
Для выяснения возможности протекания ОВ реакции нужно знать ОВ потенциалы вступающих в реакцию веществ.
ОВ потенциал (редокс потенциал) характеризует электрическую работу, затрачиваемую на отрыв электрона от частицы при ее переводе из восстановленной формы в окисленную.
Количественно зависимость редокс-потенциала от концентрации окисленной и восстановленной форм выражают уравнением Нернста–Петерса:
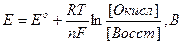
где R –газовая постоянная, равна 8,314 Дж/моль·К;
Т – абсолютная температура раствора;
n- число отдаваемых или приобретаемых электронов;
F- число Фарадея, равное 96484,56 Кл·моль (количество электричества, соответствующее переносу 1 моль электронов);
[окисл] – концентрация окисленной формы;
[восст] – концентрация восстановленной формы;
Ео - обозначает нормальный стандартный окислительно-восстановительный потенциал системы.
Самопроизвольное протекание окислительно-восстановительной реакции при стандартных условиях возможно, если Ео (окислителя) > Ео (восстановителя).
При 25о формула Нернста-Петерса принимает вид
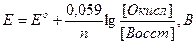
При 20о формула Нернста-Петерса принимает вид
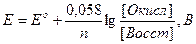
Нормальные редокс-потенциалы некоторых редокс пар по отношению к нормальному водородному электроду даны в справочниках. По ним можно
а) сравнить величины нормальных редокс-потенциалов различных систем;
б) установить какую роль (окислителя или восстановителя) будут играть атомы, молекулы, или ионы данного вещества;
в) предсказать возможное направление ОВ реакции, состав продуктов реакции и рассчитать константу равновесия;
г) быстро и точно составить уравнение ОВ реакции.
Дата добавления: 2017-11-04; просмотров: 1477;
