Механизмы химических реакций в сложных технологических процессах
Кинетические исследования основаны на том, что экспериментально определяемые концентрации Сi или конверсии Хi зависят от дифференциальных уравнений скорости и от параметров процесса. Поэтому необходимо исследовать все параметры, которые могут влиять на скорость: начальные концентрации реагентов, а иногда и продуктов, концентрацию катализатора, температуру, продолжительность реакции.
Наиболее сложен вывод концентрационной зависимости. Обычно проводят серию опытов при постоянной температуре и при постоянных параметрах химической реакции. В этих экспериментах определяют влияние других факторов и вид кинетического уравнения. Затем проводят вторую серию опытов при разной температуре и находят зависимость параметров химической реакции от температуры.
Кинетические исследования проводят в аппаратах с идеальным режимом, обеспечивающих наиболее простую связь результатов исследований с варьируемыми параметрами. Такими аппаратами являются реакторы идеального смешивания и вытеснения.
Периодический реактор идеального смешивания характеризуется отсутствием градиента концентраций и температур по объему, что обеспечивается интенсивным смешиванием. В реакторах периодического действия идеального смешивания обычно исследуется кинетика жидкофазных (гомо- и гетерофазных) реакций.
При использовании реактора идеального вытеснения реакционная масса перемещается вдоль оси потока, вытесняя предыдущие слои. Все элементы потока движутся вдоль оси с одной и той же линейной скоростью (поршневой режим) при условии отсутствия торможения потока стенками или насадкой. Такие реакторы применяют для исследований реакций в потоке, особенно газофазных гетерогенно-каталитических.
Обработка результатов экспериментов начинается с выдвижения гипотезы о механизме реакций, что позволяет написать их кинетические уравнения и проверить их соответствие результатам эксперимента.
Схему превращений выбирают на основе литературных данных, общих положений органической химии или путем постановки специальных кинетических опытов. При составлении схемы превращений учитываются данные об относительных скоростях реакций, термодинамические данные о вероятности протекания реакции в данных условиях, ее обратимости и т. д.
Из кинетических наиболее применим способ изолирования отдельных реакций – изучение продуктов превращения реакции в отсутствие каких-либо компонентов или, наоборот, в присутствии продуктов разных стадий.
Судить о возможном механизме протекания реакций можно и по соотношению скоростей накопления отдельных продуктов. Так, при параллельном протекании реакций соотношение скоростей накопления отдельных продуктов в нулевой момент времени величина положительная (не равная 0) и не меняющаяся по ходу протекания реакции.
В последовательных реакциях соотношение скоростей накопления отдельных продуктов в начальный момент времени равно 0 и изменяется во времени.
Таким образом, в каждом случае находится свой способ проверки, и на основании простой гипотезы выводятся уравнения для всех ключевых компонентов.
После выдвижения гипотезы о схеме превращений выдвигается гипотеза о механизме и кинетике каждой простой реакции или об их совокупности и построении кинетического уравнения.
В химической кинетике с учетом ее механизма принято делить все реакции на элементарные и неэлементарные (сложные). Элементарные реакции протекают в одну необратимую стадию без образования промежуточных частиц или комплексов (кроме переходного состояния). К ним применим закон равновесных концентраций, и их скорость пропорциональна концентрации компонентов в степенях, равных стехиометрическому коэффициенту. По числу молекул, принимающих участие в элементарном акте, такие реакции делятся на моно-, би- и три молекулярные (встречаются редко).
Для элементарных реакций частные порядки реакции по компонентам совпадают со стехиометрическими коэффициентами. От порядка реакции зависит размерность константы скорости.
Мономолекулярная реакция: С 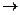 А (4.1)
А (4.1)
W = kCA, k = W/C, время-1. (4.2)
Бимолекулярная реакция: С 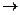 А + В (4.3)
А + В (4.3)
W = k CACB, k = W/ C2, л∙моль-1∙время-1; (4.4)
или С 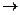 2А (4.5)
2А (4.5)
W = k CA2, k = W/ C2, л∙моль-1∙время-1 (4.6)
В общем виде скорость, лn-1∙моль1-n∙время-1,
W = k CAn, k = W/ Cn (4.7)
Сложные, или неэлементарные, реакции могут состоять только из элементарных реакций. Однако в большинстве случаев органические реакции представляют собой совокупность элементарных стадий, протекающих с образованием промежуточных частиц (радикалов, свободных атомов, ион-радикалов, ионов) или комплексов (с катализатором, растворителями, реагентом и т.д.). Описание кинетики таких реакций очень сложно.
Гипотезу о механизме сложных реакций выдвигают на основе имеющихся теоретических представлений. Необходимое условие правильного представления этого механизма: при суммировании всех стадий промежуточные частицы и компоненты сокращаются, давая стехиометрическое уравнение реакции.
Из гипотезы о механизме реакции выводят ее кинетическое уравнение, исходя из положения, что для каждой элементарной стадии верен простой вид кинетического уравнения.
При описании кинетики процесса составляют систему дифференциальных уравнений для скоростей превращения ключевых веществ, для чего записывают скорости их превращения через скорости элементарных реакций (3.14).
Например, для двухстадийной необратимой реакции
A + B 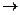 С + D, (4.8)
С + D, (4.8)
которая протекает по механизму
k1
1) А 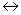 L + D (4.9)
L + D (4.9)
k-1
2) L + B 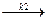 С, (4.10)
С, (4.10)
где k-1, k1, k2 – константы скоростей реакций; (1) и (2) – две ключевые реакции; А (или С) и L – два ключевых вещества.
Для этих независимых элементарных реакций существуют следующие уравнения скорости:
− 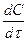 А =
А = 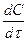 С = k2CLCB; (4.11)
С = k2CLCB; (4.11)
− 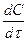 L = k1CA – k-1CLCD + k2CLCB (4.12)
L = k1CA – k-1CLCD + k2CLCB (4.12)
Система простая, так как имеются всего две независимые реакции и две стадии, но в обоих уравнениях участвует концентрация СL, которую не всегда просто определить. В действительности в большинстве сложных реакций устанавливается квазистационарный режим. При этом скорость превращения промежуточной частицы (dCL/d 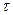 ) практически равна нулю (сколько образовалось, столько израсходовалось), т.е. продолжительность жизни вещества L неизмеримо мало по сравнению с продолжительностью реакции. Пользуясь этим положением, можно найти выражение для CL из (4.13) и подставить его в кинетическое уравнение (4.11):
) практически равна нулю (сколько образовалось, столько израсходовалось), т.е. продолжительность жизни вещества L неизмеримо мало по сравнению с продолжительностью реакции. Пользуясь этим положением, можно найти выражение для CL из (4.13) и подставить его в кинетическое уравнение (4.11):
k1CA – k-1CLCD + k2CLCB = 0; (4.13)
k1CA
CL = ─────── ; (4.14)
k-1CD + k2CB
k1k2CACB
W = k2CLCB = ────────── . (4.15)
k-1CD + k2CB
Такой метод построения кинетических уравнений предложен М.Боденштейном и Н.Н. Семеновым и называется методом стационарных состояний (или концентраций).
Уравнение (4.15) справедливо при сравнимых скоростях реакций обеих стадий. Предположим, что k-1CD 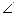 k2CB, тогда скорость реакции определяется скоростью на первой стадии (реакция имеет нулевой порядок по веществу В и таким образом не зависит от концентрации вещества В). Если k-1CD >k2CB, то скорость реакции определяется скоростью второй стадии, а в первой быстро устанавливается равновесие. Стадия, скорость которой определяет скорость всей реакции, называется лимитирующей.
k2CB, тогда скорость реакции определяется скоростью на первой стадии (реакция имеет нулевой порядок по веществу В и таким образом не зависит от концентрации вещества В). Если k-1CD >k2CB, то скорость реакции определяется скоростью второй стадии, а в первой быстро устанавливается равновесие. Стадия, скорость которой определяет скорость всей реакции, называется лимитирующей.
Дата добавления: 2017-11-04; просмотров: 544;
