Зависимость скорости реакции от температуры
Скорость химической реакции обычно растет с повышением температуры. Экспериментально при изучении кинетики химических реакций было обнаружено, что при увеличении температуры Т на 100С скорость реакции возрастает в 2 – 4 раза. Для характеристики зависимости скорости реакции от температуры был введен температурный коэффициент
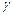 = kТ+10 / kТ (3.17)
= kТ+10 / kТ (3.17)
Эта зависимость может быть выражена в виде уравнения Аррениуса:
k = k0 exp(− 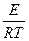 ), (3.18)
), (3.18)
где k – константа скорости реакции;k0 – предэкспоненциальный множитель; Е – энергия активации реакции, кДж/моль; R – универсальная газовая постоянная; Т – температура, К.
Это уравнение часто используется в логарифмической форме:
ln k = ln k0 − 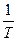
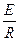 (3.19)
(3.19)
Энергия активации элементарной реакции Е – это минимальный избыток энергии над средней внутренней энергией молекул, необходимый для того, чтобы произошло химическое взаимодействие (энергетический барьер, который должны преодолеть молекулы при переходе из одного состояния реакционной системы в другое).
Предэкспоненциальный множитель k0 учитывает число соударений частиц, вероятность распада активированного комплекса реакции на исходные реагенты без образования продуктов реакции, пространственную ориентацию молекул реагентов, а также ряд других факторов, влияющих на скорость реакции и не зависящих от температуры. Предэкспоненциальный множитель измеряется время-1; объем/(моль∙время).
Закон Аррениуса является одним из важнейших в химической кинетике, дающим большую информацию о механизме реакции. Он имеет универсальное значение для элементарных реакций. Отклонение от него говорит о сложном механизме реакции.
Энергия активации сложных реакций представляет собой алгебраическую сумму энергий активации стадий и может быть отрицательной.
Из уравнения Аррениуса видно, что принципиально возможен еще один путь управления скоростью химической реакции – изменение энергии активации реакции Е. Высота энергетического барьера реакции тесно связана с ее механизмом. Если изменить путь реакции, направив ее к конечным продуктам через некоторые новые промежуточные комплексы, то можно изменить и энергию активации. Такой путь возможен при использовании катализаторов.
Однако в случае применения катализатора для ускорения целевого процесса при проведении параллельных реакций возможна такая ситуация, когда энергия активации побочной реакции окажется выше энергии активации целевой реакции, и тогда увеличение температуры, часто применяемое для интенсификации химико-технологических процессов, приведет к снижению селективности по целевому продукту.
Дата добавления: 2017-11-04; просмотров: 354;
