Функциональная зависимость скорости химической реакции от концентрации компонентов реакционной смеси называется кинетическим уравнением реакции.
Основные понятия химической кинетики
Химическая термодинамика позволяет решить вопрос о направлении протекания химических реакций и оценить предельно достижимые (равновесные) состояния реакционной системы. Однако она не может ответить на вопросы, имеющие чрезвычайно важное практическое значение в химической технологии: как быстро пройдет химическое превращение, за какой промежуток времени будет получено то или иное количество продукта реакции.
Решающее значение при выборе условий проведения химико-технологических процессов имеют вопросы скорости химических превращений, изучаемые химической кинетикой.
Кинетический метод исследования имеет значение в двух аспектах:
● теоретическом (обоснование механизма реакций и решения вопросов, связанных с реакционной способностью веществ);
● практическом (для расчета и моделирования химических реакторов и оптимизации, протекающих в них процессов).
Знание механизма необходимо для определения лимитирующей стадии, для установления главных и побочных путей и выбора способа управления процессом для повышения его производительности и селективности. Знание
механизма – это важнейший элемент создания интенсивных, высокоселективных и энергосберегающих технологий.
Скоростью химической реакцииWi по компоненту i называется изменение его количества, происходящее за единицу времени 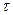 в единице объема V (для гомогенных реакций) или на единице поверхности раздела фаз S (для гетерогенных реакций).
в единице объема V (для гомогенных реакций) или на единице поверхности раздела фаз S (для гетерогенных реакций).
Скорость гомогенных реакций, моль/(объем ∙ время),
dni
Wi = 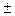 ────, (3.1)
────, (3.1)
Vd 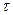
где Wi – скорость i реакции, моль/(л ∙ с) или кмоль/(м3∙ ч); 
ni – количество вещества, моль;
V – объем реагирующей смеси, л или м3;
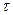 − время (продолжительность реакции), с или ч.
− время (продолжительность реакции), с или ч.
Скорость химической реакции может быть определена по любому компоненту, участвующему в реакции; она всегда положительна, поэтому знак (положительный или отрицательный) перед производными dni / d 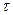 должен определяться тем, является ли вещество i исходным реагентом (отношение dni / d
должен определяться тем, является ли вещество i исходным реагентом (отношение dni / d 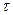 отрицательное) или продуктом (отношение dni / d
отрицательное) или продуктом (отношение dni / d 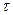 положительное).
положительное).
При V =const = 1л формулу (3.1) можно переписать в следующем виде, моль/(объем∙время):
dСi
Wi = 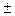 ────, (3.2)
────, (3.2)
d 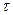
где Сi – концентрация вещества i, моль/л, кмоль/м3.
Скорость гетерогенных реакций, моль/(площадь поверхности ∙ время),
dni
Wi = 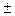 ────, (3.3)
────, (3.3)
Sd 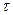
где S - площадь поверхности раздела фаз, м2.
Если площадь поверхности раздела фаз трудно определить, например, в гетерогенно-каталитических реакциях, скорость превращения относят к единице массы или объема катализатора и определяют:
в моль/(масса∙катализатора время)
dni
Wi = 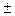 ─────, (3.4)
─────, (3.4)
ткатd 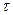
где ткат – масса катализатора, кг;
или в моль/(объем катализатора∙время)
dni
Wi = 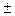 ────, (3.5)
────, (3.5)
Vкатd 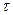
где Vкат – объем катализатора, м3.
Если реакция протекает в проточной схеме в стационарных установках, скорость ее измеряется как производная молярных потоков(Fi моль/продолжительность) по реакционному объему или массе катализатора:
в моль/ (объем катализатора∙продолжительность)
dFi
Wi = 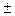 ────, (3.6)
────, (3.6)
Vкатd 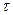
в моль/(масса катализатора∙продолжительность)
dFi
Wi = 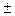 ───── (3.7)
───── (3.7)
ткатd 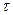
В общем случае скорость реакции зависит от внешних условий: давления Р, температуры Т и т. д. При заданных постоянных внешних условиях скорость реакции является фукцией концентрации реагентов:
Wi = f (CA, CB, …, Ci) (3.8)
Функциональная зависимость скорости химической реакции от концентрации компонентов реакционной смеси называется кинетическим уравнением реакции.
Дата добавления: 2017-11-04; просмотров: 466;
