КЛАССИФИКАЦИЯ СИСТЕМ В СООТВЕТСТВИИ С ПРАВИЛОМ ФАЗ ГИББСА.
1) По числу компонентов:
К=1 – однокомпонентная
К=2 – двухкомпонентная
К=3 – трехкомпонентная
2) По числу фаз:
Ф=1 – однофазная (гомогенная)
Ф=2 – двухфазная (гетерогенная)
Ф=3 – трехфазная (гетерогенная)
3) По числу степеней свободы:
С=0 – инвариантная
С=1 – моновариантная
С=2 – дивариантная
С=3 – тривариантная
t
Например, CaCO3(тв) → CuO(тв)+CO2(г)↑
3 компонента, 2 фазы (гетерогенная система)
С=К-Ф+2=3-2+2=3
Число степеней свободы не может быть меньше нуля. Отрицательное значение числа степеней свободы указывает на то, что не все компоненты находятся в равновесии во всех фазах.
Однокомпонентные системы.
Для иллюстрации рассмотрим простейший случай – однокомпонентную систему.
При К=1 соотношение С=К-Ф+2 принимает вид: С=3-Ф.
Так как число степеней свободы не может быть отрицательным, то в этом случае число фаз, находящихся в равновесии, не может быть больше трех. Следовательно, по числу фаз можно иметь здесь только три типа систем: однофазные, двухфазные и трехфазные. Для однофазных систем С=2, для двухфазных С=1 и для трехфазных С=0.
Фазовое состояние системы в зависимости от внешних условий и состава системы определяется при помощи диаграмм состояния, или фазовых диаграмм. Такие диаграммы строятся по соответствующим опытным данным и широко применяются для характеристики различных систем.
ДИАГРАММА СОСТОЯНИЯ Н2О.
Рассмотрим диаграмму состояния воды (однокомпонентная система), на которую из числа внешних факторов действуют температура и давление.
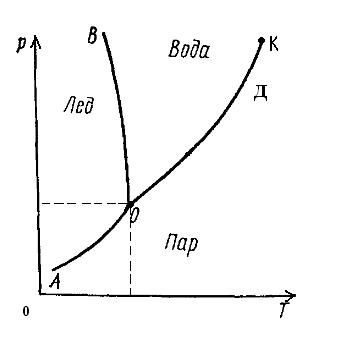
Остановимся сначала на областях, ограниченных кривыми АОВ, ВОД или АОД.
Области:
АОВ твердая
ВОД жидкая однофазные гомогенные области
АОД паровая (Ф=1)
В соответствии с правилом фаз Гиббса С=1-1+2=2, т.е. система дивариантна. Следовательно, в пределах границ обозначенных областей можно изменять и температуру, и давление, не изменяя вида и числа фаз. Причем такие изменения могут быть одновременными и независимыми друг от друга.
Линии (характеризуют равновесное состояние двухфазной системы):
АО тв ↔ пар
ВО тв ↔ ж двухфазные гетерогенные системы
ДО ж ↔ пар (Ф=2)
ВО – равновесие твердой и жидкой фаз, т.е. между процессами затвердевания и плавления; ДО – равновесие жидкой и газовой фаз, т.е. между процессами испарения и конденсации; АО – равновесие твердой и газовой (паровой) фаз, т.е. между процессами сублимации (возгонки) и десублимации.
Двухфазные системы согласно правилу фаз Гиббса С=К-Ф+2 имеют одну степень свободы С=1, т.е. система моновариантна. Не изменяя числа и вида фаз, можно в известных пределах произвольно менять или температуру, или давление, но не одновременно оба параметра. Причем с изменением одного из этих параметров (он становится фиксированным), например температуры, другой параметр (давление) тоже изменяется, но в соответствии с изменением первого таким образом, чтобы соотношение этих параметров определялось положением линий АО, ВО и ДО.
В общем случае для однокомпонентной системы, когда в равновесии находятся две фазы, а число степеней свободы равно единице (С=1), можно изменить давление при определенной температуре (или температуру при определенном давлении), т.е. две фазы будут находиться в равновесии только при одном фиксированном параметре.
Рассмотрим диаграмму состояния диоксида углерода, когда твердая, жидкая и газообразная (паровая) фазы являются термодинамически устойчивой формой вещества; при этом две или даже три фазы находятся в равновесии друг с другом. Как и в отношении воды, области, ограниченные кривыми АОВ, ВОД и АОД, характеризуют нахождение диоксида углерода в какой-либо одной фазе. Линии ОВ, ОД и ОА отражают состояние двухфазной системы.
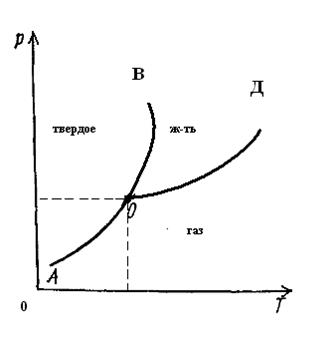
Существенное отличие диаграммы состояния диоксида углерода от диаграммы состояния воды заключается в наклоне линии ОВ, определяющей процессы затвердевания и плавления. Наклон линии ОВ на диаграмме состояния диоксида углерода вправо от вертикальной линии типичен для веществ, которые расширяются при плавлении.
Из диаграммы состояния воды следует, что с ростом давления температура плавления льда снижается – линия ОВ наклонена влево. Подобное явление объясняется большей плотностью воды по сравнению с плотностью льда. Согласно принципу Ле Шателье-Брауна, равновесие вода-лед при росте давления смещается в сторону воды, имеющей большую плотность и меньший удельный объем. Если при повышении давления понизить температуру, то равновесие сместится в сторону образования льда.
Снижение плотности воды при затвердевании – аномальное явление. У подавляющего большинства веществ плотность твердой фазы больше, чем жидкой, а с ростом давления равновесие смещается в сторону образования твердой фазы в противоположном направлении по сравнению с водой – сопоставим положение линии ОВ на диаграммах состояния диоксида углерода и воды.
Точка О – тройная точка, означает равновесие 3 фаз: тв ↔ ж ↔ пар
Трехфазная система становится инвариантной, т.е. число степеней свободы в соответствии с правилом фаз Гиббса равно нулю (С=0).
Существует только единственное сочетание температуры и давления, при котором все три фазы находятся в равновесии:
Тт.т.= 273,16 К (0,01 0С)
Рт.т.= 610,48 Па (4,579 мм.рт.ст.)
Для диоксида углерода соответственно 216,6 К (-56,6 0С) и 5,18∙105 Па (5,11 атм.). Любое изменение температуры или давления приведет к изменению числа фаз, и система из трехфазной превратится в двух- или даже в однофазную.
Кривая ОД, характеризующая переход жидкость-пар, обрывается в критической точке К. Критическая точка, отражает состояние равновесной системы, в которой все термодинамические свойства тождественны, а сама система становится условно инвариантной (Сусл=К-Ф+2=1-3+2=0).
Критическая точка для воды:
Тк.т.= 645,35 К
Рк.т.=221,206·105 Па
Дата добавления: 2017-09-19; просмотров: 669;
