Основные газовые законы
Количественные расчеты между веществами, находящимися в газообразном состоянии, удобнее производить не по массе, а по объему. Наиболее важными законами газового состояния являются законы Авогадро, Менделеева-Клапейрона и Дальтона.
Закон Авогадро:в равных объемах любых газов, взятых при одной и той же температуре и одинаковом давлении, содержится одинаковое число молекул. Это означает, что одно и то же число молекул любого газа занимает при одинаковых физических условиях один и тот же объем. Из закона Авогадро вытекает два важных следствия:
Следствие 1: при одинаковых физических условиях (то есть Р,Т = const) 1 моль любого газа занимает один и тот же объем, который называют молярным объемом VM. При нормальных условиях (н.у.) – давление 101,325 кПа (1 атм или 760 мм рт. ст.), температура 273 К (0 °С) – этот объем равен V 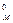 = 22,4 дм3/моль;
= 22,4 дм3/моль;
Следствие 2: отношение масс равных объемов различных газов равно отношению их молярных масс:
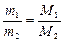 , (3)
, (3)
где m1, m2 – массы газов, г; M1, M2 – молярные массы газов, г/моль. Отношение 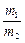 называется относительной плотностью первого газа по второму D
называется относительной плотностью первого газа по второму D 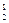 . Тогда из формулы (3) следует, что
. Тогда из формулы (3) следует, что
M1 = M2 × D 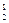 . (4)
. (4)
Зависимость между количеством идеального газа, его объемом, давлением и температурой можно выразить равенством, которое отражает закон Менделеева-Клапейрона:
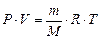 , (5)
, (5)
где 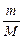 = n, моль; P – давление, Па; V – объем, м3; R = 8,314
= n, моль; P – давление, Па; V – объем, м3; R = 8,314 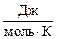 - универсальная газовая постоянная; T – температура, К.
- универсальная газовая постоянная; T – температура, К.
Если газообразная фаза представляет собой смесь нескольких газов, химически не взаимодействующих друг с другом, то общее давление такой смеси Р можно определить по закону Дальтона:
Р = Р1 + Р2 + Р3 + … , (6)
где Р – общее давление; Р1, Р2, Р3 … - парциальные давления газов 1, 2, 3 … .
Парциальным давлением газа Рi в смеси называется давление, которое производил бы этот газ, если бы при тех же физических условиях он занимал объем всей газовой смеси. Его можно рассчитать по формулам:
Рi = 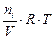 , (7)
, (7)
Pi = xi × P, (8)
где ni – число моль i-го газа в смеси; 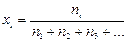 – мольная доля i-го газа в смеси.
– мольная доля i-го газа в смеси.
Дата добавления: 2017-09-19; просмотров: 315;
