Сосудистые реакции. Экссудация плазмы, эмиграция форменных элементов крови и фагоцитоз
Экссудация (от лат. exsudatio) – выпотевание. Этот компонент воспаления включает в себя триаду:
а) сосудистые реакции и изменения кровообращения в очаге воспаления;
б) выход жидкой части крови из сосудов – собственно экссудацию;
в) эмиграцию (от лат. emigration – выселение) – выход лейкоцитов в очаг воспаления и развитие фагоцитоза.
Динамика сосудистых реакций и изменения кровообращения при развитии воспаления стереотипны. Вначале, хотя и не всегда, возникает кратковременный рефлекторный спазм артериол с замедлением кровотока и развитием ишемии, затем вазодилятация и, сменяя друг друга, развивается артериальная и венозная гиперемия, престаз и стаз – остановка кровотока.
При воздействии на ткань флогогенного агента, как правило, развивается кратковременное повышение тонуса стенок артериол и прекапилляров, т.е. локальная вазоконстрикция. Эта стадия сосудистых реакций в виде местной вазоконстрикции обычно приводит к нарушению кровотока – ишемии. Причина такой часто возникающей вазоконстрикции – стресорные реакции, высвобождение под влиянием альтерирующего фактора БАВ сосудосуживающего действия: КА, тромбоксана, некоторых ПГ.
В дальнейшем вследствие образования и действия в очаге воспаления большого количества вазоактивных веществ (медиаторов воспаления), которые подавляют автоматию гладкомышечных элементов стенки артериол и прекапилляров и вызывают их расслабление, развивается вазодилатация, возникает АГ. Кроме того, сосуды расширяются и в результате «паралича» вазоконстрикторов и доминирования парасимпатических влияний на стенку сосудов, ацидоза, гиперкалийионии, снижения эластичности окружающей сосуды соединительной ткани. Таким образом, из механизмов, приводящих к развитию АГ, важное значение имеет нейрогенный, гуморальный и миопаралитический. АГ под влиянием целого ряда факторов в очаге воспаления сменяется ВГ. Возникновение ВГ обусловлено: I) факторами крови, 2) факторами сосудистой стенки, 3) факторами окружающих тканей.
К факторам, связанным с кровью, относится краевое расположение лейкоцитов, набухание эритроцитов, выход жидкой части крови в воспаленную ткань и сгущение крови, образование микротромбов вследствие активации фактора Хагемана и уменьшения содержания гепарина. Влияние факторов сосудистой стенки на ВГ проявляется набуханием эндотелия, в результате чего просвет мелких сосудов еще больше суживается. Измененные венулы теряют эластичность и становятся более податливыми сдавливающему действию экссудата. И, наконец, проявление действия тканевых факторов состоит в том, что отечная ткань, сдавливая вены и лимфатические сосуды, способствует развитию ВГ.
С развитием престатического состояния наблюдается маятникобразное движение крови – во время систолы она движется от артерий к венам, во время диастолы – в противоположном направлении. Наконец, движение крови может полностью прекратиться и развивается стаз, следствием которого могут быть необратимые изменения клеток крови и тканей.
Выход жидкой части крови в интерстиций очага воспаления (собственно экссудация) происходит вследствие резкого повышения проницаемости гистогематического барьера и, как следствие, усиления процесса фильтрации и микровезикулярного транспорта. Выход жидкости и растворенных в ней веществ осуществляется в местах соприкосновения эндотелиальных клеток. Щели между ними могут увеличиваться при расширении сосудов, а также, при сокращении контрактильных структур и округлении эндотелиальных клеток. Кроме того, клетки эндотелия способны «заглатывать» мельчайшие капельки жидкости (микропиноцитоз), переправлять их на противоположную сторону и выбрасывать в близлежащую среду (экструзия). Транспорт жидкости в ткани зависит также и от физико-химических изменений, происходящих по обе стороны сосудистой стенки. В связи с выходом белка из сосудистого русла, его количество вне сосудов увеличивается, что способствует повышению онкотического давления в тканях. При этом в очаге воспаления происходит под влиянием лизосомальных гидролаз расщепление белковых и других крупных молекул на более мелкие. Гиперонкия и гиперосмия в очаге альтерации создают приток жидкости в воспаленную ткань. Этому способствует и повышение внутрисосудистого гидростатического давления в связи с изменениями кровообращения в очаге воспаления.
Результатом экссудации является заполнение интерстициальных пространств и очага воспаления экссудатом. Экссудат – жидкость, выходящая из микрососудов, содержащая большое количество белка (не менее 2-3%) и, как правило, форменные элементы крови, и накапливающая в тканях и (или) полостях тела при воспалении.
В зависимости от наличия в экссудате клеток и их типа, а также от химического состава экссудата различают фибринозный, серозный, геморрагический, гнойный, гнилостный и смешанные виды экссудатов.
Фибринозный экссудат содержит большое количество фибриногена и фибрина; серозный экссудат состоит из полупрозрачной жидкости, богатой белком (более 2-3%), и немногочисленных, в том числе форменных элементов крови; геморрагический экссудат содержит большое количество белка и эритроцитов, а также другие форменные элементы крови; гнойный экссудат – мутная густая жидкость, содержащая до 6 - 8% белка и большое количество лейкоцитов, микроорганизмов, погибших клеток ткани.
Любой вид экссудата может приобрести гнилостный (ихорозный) характер при внедрении в очаг воспаления гнилостной микрофлоры.
Смешанные формы экссудата могут быть самыми разнообразными (например, серозно-фибринозный, гнойно-фибринозный, гнойно-геморрагический и др.).
Раннюю транзиторную реакцию роста проницаемости сосудов обусловливает действие гистамина, ПГЕ2, ЛТЕ4, серотонина, брадикинина. Ранняя транзиторная реакция в основном затрагивает венулы с диаметром не более чем 100 мкм. Проницаемость капилляров при этом не меняется. Повреждение клеток эндотелия и базальной мембраны стенки микрососудов факторами лейкоцитов и внеклеточными БАВ приводит к длительной реакции роста проницаемости. В результате действия этиологического фактора происходит некроз эндотелиальных клеток на уровне артериол небольшого диаметра, капилляров и венул, что ведет к стойкому возрастанию их проницаемости. Отсроченная и стойкая реакция роста проницаемости микрососудов развивается в очаге воспаления через часы или сутки от его начала. Она характерна для воспаления, вызванного ожогами, излучением и аллергическими реакциями отсроченного (замедленного) типа. Биологический смысл экссудации как компонента воспаления состоит в:
- ограничении очага воспаления через сдавление кровеносных и лимфатических микрососудов вследствие интерстициального отека, а также в разведении флогогенов и факторов цитолиза в очаге воспаления для предотвращения избыточной вторичной альтерации;
- доставке в очаг воспаления Ig и др. агентов, способствующих уничтожению микроорганизмов, поврежденных клеток и клеточных структур тканей.
Сосудистые реакции и изменения кровообращения в очаге воспаления, сопровождающиеся изменением проницаемости сосудов стенки, приводят также к эмиграции лейкоцитов и других форменных элементов крови за пределы микрососудов в интерстициальное пространство. При этом особое значение в развитии воспалительной реакции имеет эмиграция лейкоцитов.
Эмиграция лейкоцитов (лейкодиапедез) – выход лейкоцитов из просвета сосудов через сосудистую стенку в окружающую ткань. Этот процесс совершается и в норме, но при воспалении приобретает гораздо большие масштабы. Смысл эмиграции состоит в том, чтобы в очаге воспаления скопилось достаточное число клеток, играющих роль в развитии воспаления (фагоцитоз и т.д.),
В настоящее время механизм и последовательность процессов эмиграции изучены довольно хорошо. Последовательность процесса эмиграции включает стадии краевого стояния лейкоцитов, их адгезии к эндотелию и проникновения через сосудистую стенку, а также направленного движения лейкоцитов в очаге воспаления (рис. 15, 16).


 |  |
| Рисунок 15. Краевое стояние лейкоцитов (электронная микрофотография кардиомиоцита) | Рисунок 16. Переход лейкоцитов через сосудистую стенку (электронная микрофотография кардиомиоцита) |
На стадии краевого стояния (маргинации) условно выделяют два последовательных этапа:
- выход лейкоцитов из осевого цилиндра кровяного потока и приближение к стенке микрососуда, обращенной в сторону очага воспаления, причиной чего является высокая концентрация хемоатрактантов у стенки микрососуда, расположенного в очаге воспаления, и замедление тока крови; особенно в венулах;
- медленное движение (качение) лейкоцитов вдоль стенки микрососуда по поверхности клеток эндотелия (rolling - роллинг). Причины: высокое содержание медиаторов воспаления в очаге повреждения и выделение селектинов (Е-,Р-,L-селектин) и интегринов (VLA-1,-2,-3,…) клетками эндотелия и тромбоцитами. В последующем имеет место адгезия (рецепторно-опосредованое прилипание) лейкоцитов к мембранам эндотелиальных клеток стенок микрососудов, обусловленная интегринами и Ig-подобными молекулами клеточной адгезии (ICAM), связыванием CD15 лейкоцитов с Е-селектином эндотелия и приводящая к фиксации полиморфонуклеаров. Адгезия создает условия для диапидеза лейкоцитов.
Выход лейкоцитов из просвета сосудов через сосудистую стенку в очаг воспаления, их проникновение через стенку сосуда реализуется через пласт клеток эндотелия, межклеточный матрикс стенки сосудов и базальную мембрану эндотелия (время – около 3-6 мин).
При прохождении лейкоцитов между клетками эндотелия происходит взаимодействие экспрессированных на их поверхности молекул интегринов с молекулами адгезии. Различные типы лейкоцитов (нейтрофилы, моноциты, эозинофилы, лимфоциты) используют в ходе экстравазации разный спектр молекул адгезии. Прохождение лейкоцитов через базальную мембрану микрососудов сопровождается высвобождением лейкоцитами гидролитических ферментов (например, коллагеназ и эластаз). Это обеспечивает гидролиз волокон и основного вещества базальной мембраны, что способствует выходу лейкоцитов из сосудистого русла. Считается, что гранулоциты (через межэндотелиального щели) и агранулоциты (путем цитопемфиза – трансэндотелиального переноса) проходят через сосудистую стенку и продвигаются к объекту фагоцитирования. Гранулоциты выходят за пределы сосуда на стыке между эндотелиальными клетками. Это становится возможным после округления эндотелиоцитов и увеличения интервалов между ними. После выхода лейкоцитов контакты между эндотелиальными клетками восстанавливаются. Амебоидное движение лейкоцитов возможно благодаря обратимым изменениям состояния их цитоплазмы (взаимоперехода геля в золь – тиксотропии) и поверхностного натяжения мембран, обратимой «полимеризации» сократительных белков – актина и миозина и использованию энергии АТФ анаэробного гликолиза. Направленное движение лейкоцитов объясняется накоплением в очаге воспаления экзо- и эндогенных хемоаттрактантов – веществ, индуцирующих хемотаксис, повышением температуры (термотаксис), а также развитием условий для гальвано- и гидротаксиса.
Функцию эндогенных хемоаттрактантов выполняют фракции системы комплемента, в особенности компонент С5а. Свойствами хемоаттрактантов обладают кинины и активированный фактор Хагемана. Экзогенными хемоаттрактантами являются пептиды бактериального происхождения в особенности те, которые содержат N-формиловые группы. При значительном повышении проницаемости стенок сосудов в ткань очага воспаления пассивно выходят эритроциты и тромбоциты, что часто наблюдается при развитии инфекции со значительной интоксикацией организма (при сибирской язве, чуме), при поражении тканей ионизирующим излучением.
За пределами стенки микрососуда начинается направленное (ориентированное) движение лейкоцитов к зоне поражения – хемо- и электротаксис. Ориентированное движение клеток и организмов под влиянием – хемоаттрактантов (в соответствии с градиентами их концентрации) получило название – хемотаксис. В хемотаксисе лейкоцитов большое значение имеет система комплемента и прежде всего компоненты С3а и С5а. Лейкотаксически активные компоненты системы комплемента С3а и С5а образуются в очаге воспаления под влиянием различных ферментов: трипсина, плазмина, уровень которых в условиях альтерации возрастает.
Под влиянием лейкотаксических веществ происходит скопление хеморецепторов (кэппинг) на стороне лейкоцита, обращенной к региону наибольшей концентрации хемоаттрактантов. Этот полюс («голова») лейкоцита становится ведущим, а хвостовой – ведомым. В дальнейшем изменяется коллоидное состояние цитозоля лейкоцита (переход из состояния геля в золь). Совершается сокращение актомиозина «хвостового полюса» лейкоцита и соответственно происходит направленное движение лейкоцита к объекту фагоцитоза в соответствии с градиентами концентраций хемоаттрактантов. Для процесса эмиграции лейкоцитов наряду с хемотаксисом, имеет значение и электротаксис – направленное движение лейкоцитов (несущих на своей поверхности отрицательный заряд) по направлению к эпицентру очага воспаления (где накапливаются поврежденные и погибшие клетки, ионы Н+, К+ – формирующие положительный заряд).
Эмиграция лейкоцитов в очаг воспаления характеризуется определенной очередностью: сначала эмигрируют нейтрофильные гранулоциты, затем – моноциты и, наконец – лимфоциты. Более позднее проникновение моноцитов объясняется их меньшей хемотаксической чувствительностью. В процессе завершения воспалительного процесса в очаге наблюдается постепенное исчезновение клеток крови, начиная с тех лейкоцитов, которые появились раньше (нейтрофильные гранулоциты). Позже элиминируются лимфоциты и моноциты. Временная последовательность выхода разных видов лейкоцитов из сосудистого русла в очаг воспаления обусловлена стадийностью появления факторов хемотаксиса и адгезии. К последним относят фактор системы комплемента С5а, фактор 4 тромбоцитов, лимфокины и другие.
Проникнув в очаг воспаления, фагоциты выполняют свою главную функцию – фагоцитарную.
Фагоцитоз(с греч phagos – пожирание, kytos – клетка) – «пожирание клеток» – эволюционно выработанная защитно-приспособительная реакция организма, заключающаяся в распознавании, активном захвате (поглощении), инактивации и разрушении микроорганизмов, поврежденных клеток и инородных частиц специализированными клетками – фагоцитами. «Нет воспаления без фагоцитоза» И.И. Мечников.
Необходимо отметить, что в развитии учения о фагоцитозе особую роль сыграли исследования И. И. Мечникова. На основании своих наблюдений им была выдвинута биологическая теория воспаления.
В настоящее время принято различать два основных класса фагоцитирующих клеток: микрофаги и макрофаги. К микрофагам отнесены полиморфноядерные гранулоциты: нейтрофилы (в наибольшей мере), эозино- и базофилы (существенно меньше). Их называют микрофагами, поскольку диаметр гранулоцитов сравнительно мал (6-8 мкм).
Макрофагами (диаметр клеток достигает 20 мкм) или мононуклеарными фагоцитами называют моноциты крови и происходящие из них тканевые макрофаги. Все клетки моноцитарного генеза (например, клетки Купфера, остеокласты, клетки микроглии, альвеолярные макрофаги, перитонеальные макрофаги и т.д.) рассматривают как систему мононуклеарных фагоцитов.
Объектами фагоцитоза для микрофагов являются микроорганизмы и инородные неживые частицы, а для макрофагов – поврежденные, погибшие и разрушенные чужеродные клетки и клетки собственного организма, а также инородные неживые частицы.
В процессе фагоцитоза условно выделяют несколько основных стадий:
- сближение фагоцита с объектом фагоцитоза (хемотаксис);
- распознавание фагоцитом объекта поглощения и прилипания (адгезия) к нему (эндоцитоз);
- поглощение объекта фагоцитом с образованием фаголизосомы;
- разрушение (переваривание) объекта фагоцитоза (киллинг-эффект, биодеградация объекта).
Распознавание и "приклеивание" лейкоцита к объекту фагоцитоза происходит в ряд этапов. К наиболее важным этапам относятся: распознавание объекта фагоцитоза (неиммунный механизм), его опсонизация (иммунный механизм) и адгезия фагоцита к объекту фагоцитоза.
Распознавание объекта фагоцитоза осуществляется с помощью рецепторов на поверхности лейкоцитов. К таким объектам относятся микроорганизмы, грибы, паразиты, собственные поврежденные, или опухолевые, или вируссодержащие клетки, а также фрагменты клеток.
Опсонизация (от лат. opsonin – усиливающий) – связывание антител с поверхностными детерминантами клеточной стенки микроорганизма и последующее поглощение образовавшегося комплекса фагоцитом. Поглощение происходит при взаимодействии Fc-фрагмента антитела с соответствующим Fc-рецептором на мембране фагоцита. Наиболее активными опсонинами являются Fc-фрагмент IgG, IgM, C-реактивный белок, фрагменты системы комплемента (С3b) и лектины. Адгезия фагоцита к объекту фагоцитоза реализуется с участием рецепторов лейкоцита FcR и молекул адгезии. В дальнейшем, микроорганизмы, покрытые молекулами IgG, эффективно фагоцитируются макрофагами или нейтрофилами. Fab-фрагменты IgG связываются с антигенными детерминантами на поверхности бактерии, после чего те же молекулы IgG своими Fc-фрагментами взаимодействуют с рецепторами Fc-фрагментов, расположенными в плазматической мембране фагоцита, и активируют фагоцитоз.
При фагоцитозе в «зернистых» лейкоцитах происходит активация реакций метаболизма («метаболический взрыв»), что обеспечивает экспрессию молекул адгезии, «респираторный взрыв», а также дегрануляцию лейкоцитов. Дегрануляция нейтрофилов, эозинофилов и базофилов сопровождается высвобождением в интерстициальную жидкость медиаторов воспаления (например, ИЛ-1β и ИЛ-6, ФНО-α, ЛТ) и активных форм кислорода, образовавшихся при «респираторном взрыве».
Поглощение объекта фагоцитоза лейкоцитами осуществляется путем погружения фагоцитируемого материала в клетку в составе фагосомы – пузырька, образованного плазматической мембраной, к которому устремляются лизосомы и с ней сливаются, образуя фаголизосому. Этот процесс сопровождается секрецией «медиаторов воспаления» и других компонентов специфических гранул лейкоцита. При дегрануляции все эти факторы поступают в воспалительный экссудат, где оказывают бактериолитическое и цитолитическое действие. Разрушение объекта фагоцитоза (биодеградация, внутриклеточное переваривание) реализуется в результате активации механизмов кислородзависимой («респираторный взрыв») и кислороднезависимой цитотоксичности фагоцитов.
Кислороднезависимые механизмы запускаются в процессе фагосомолизосомального слияния, когда с фагосомой сливаются гранулы, содержащие лактоферрин и лизоцим, азурофильные гранулы, содержащие катионные белки, протеиназы (эластаза и коллагеназа), катепсин G, дефензины и другие, которые вызывают повреждение клеточной стенки и нарушение метаболических процессов. Эти механизмы выполняют вспомогательную роль в разрушении объекта фагоцитоза.
Главная роль в деструкции объекта фагоцитоза принадлежит кислородзависимой цитотоксичности фагоцитов. Цитотоксичность сопряжена со значительным повышением интенсивности метаболизма с участием кислорода. Этот процесс получил название метаболического взрыва. При этом потребление кислорода фагоцитом может увеличиться в течение нескольких секунд во много раз (дыхательный, респираторный взрыв). В результате дыхательного взрыва образуются свободные радикалы и перекисные продукты органических и неорганических соединений – синглетный кислород ( 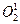 ) гидроксильный радикал (ОН–), пероксид водорода (H2О2). Пероксид водорода в присутствии миелопероксидазы приводит к образованию из H2О2 и ионов Cl– хлорноватистой кислоты (НСlО–), обладающей бактерицидным свойством, во многом аналогичным эффекту хлорной извести (NaСlО).
) гидроксильный радикал (ОН–), пероксид водорода (H2О2). Пероксид водорода в присутствии миелопероксидазы приводит к образованию из H2О2 и ионов Cl– хлорноватистой кислоты (НСlО–), обладающей бактерицидным свойством, во многом аналогичным эффекту хлорной извести (NaСlО).
Образующиеся активные формы кислорода, свободные радикалы, галогенизация и перекисное окисление компонентов захваченных объектов с участием гипохлорида оказывают цитотоксическое действие и обусловливают повреждение и деструкцию белков и липидов мембран, нуклеиновых кислот и других химических соединений объекта фагоцитоза. При этом сам фагоцит защищен от действия указанных выше агентов, поскольку в его цитоплазме имеются комплексы защитных неферментных факторов (глутатион, витамины Е, С, жирные кислоты) и ферментов (супероксиддисмутаза, устраняющая супероксидный анион, глутатионпероксидаза и каталаза, инактивирующие Н2О2).
Совместное действие механизмов обеих групп приводит к разрушению объектов фагоцитоза. Однако наряду с завершенным фагоцитозом в микрофагах наблюдается (например, при некоторых инфекциях) фагоцитоз незавершенный, или эндоцитобиоз, когда фагоцитированные бактерии или вирусы не подвергаются полному перевариванию, длительное время остаются в фагоцитах, в жизнеспособном состоянии, а иногда даже начинают размножаться в цитоплазме клетки. Существует множество причин незавершенного фагоцитоза. Основные причины это:
- мембрано- и (или) ферментопатии лизосом;
- низкая активность и (или) недостаток миелопероксидазы;
- низкая эффективность опсонизации объекта фагоцитоза;
- дефицит и (или) недостаточная экспрессия молекул адгезии.
Фагоцит, поглотивший бактерии, но не способный их переварить становится источником инфекции в организме, способствует ее дессиминации. Выявлены болезни, сопровождающиеся первичной (врожденной) или вторичной (приобретенной) недостаточностью фагоцитоза – «болезни фагоцитов». К ним относится, так называемая хроническая гранулематозная болезнь, возникающая у детей, в фагоцитах которых из-за дефекта оксидаз нарушено образование перекисей и, следовательно, процесс инактивации микробов.
Дата добавления: 2017-04-20; просмотров: 592;
