Основные химические законы.
Закон сохранения массы(М.В.Ломоносов, А.Л.Лавуазье): масса веществ, вступивших в реакцию, равна массе веществ, образующихся в результате реакции. С точки зрения атомно-молекулярного учения в результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка (химическое превращение). Поскольку число атомов до и после реакции остается неизменным, то их общая масса также изменяться не должна. Исходя из закона сохранения массы, можно составлять уравнения химических реакций и по ним производить расчеты. Этот закон является основой количественного химического анализа.
В начале 20 века формулировка закона сохранения массы подверглась пересмотру в связи с появлением теории относительности (см. п.2.4.1), согласно которой масса тела зависит от его скорости и, следовательно, характеризует не только количество материи, но и ее движение. Полученная телом энергия 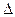 E связана с увеличением его массы
E связана с увеличением его массы 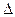 m соотношением
m соотношением 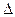 E =
E = 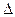 m • c2 , где с - скорость света. Это соотношение не используется в химических реакциях, т.к. 1 кДж энергии соответствует изменению массы приблизительно на 10-11 г и
m • c2 , где с - скорость света. Это соотношение не используется в химических реакциях, т.к. 1 кДж энергии соответствует изменению массы приблизительно на 10-11 г и 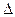 m практически не может быть измерено. Однако в ядерных реакциях, где изменение энергии
m практически не может быть измерено. Однако в ядерных реакциях, где изменение энергии 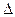 Е в миллионы раз больше, чем в химических реакциях,
Е в миллионы раз больше, чем в химических реакциях, 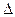 m следует учитывать.
m следует учитывать.
Закон постоянства состава вещества:
Согласно закону постоянства состава, всякое химически чистое вещество имеет постоянный качественный и количественный состав независимо от способа его получения. Качественный и количественный состав вещества показывает химическая формула. Например, независимо от того, каким способом получено вещество вода (Н2О), оно имеет постоянный состав: два атома водорода и один атом кислорода.
Из закона постоянства состава следует, что при образовании сложного вещества элементы соединяются друг с другом в определенных массовых соотношениях.
В настоящее время установлено, что этот закон всегда выполним для соединений с молекулярной структурой. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической кристаллической решеткой) не является постоянным и зависит от условий получения.
Закон кратных отношений (Дж. Дальтон) - если два элемента образуют друг с другом несколько химических соединений, то массы элементов соотносятся между собой как небольшие целые числа.
Например: в оксидах азота N2O, N2O3 , NO2 (N2O4), N2O5 число атомов кислорода, приходящихся на два атома азота, относятся между собой как 1 : 3 : 4 : 5.
Закон объемных отношений (Гей-Люссак)- объемы газов, вступающих в химические реакции, и объемы газов, образующихся в результате реакции, относятся между собой как небольшие целые числа. Следовательно, стехиометрические коэффициенты в уравнениях химических реакций для молекул газообразных веществ показывают, в каких объемных отношениях реагируют или получаются газообразные вещества. Например:
2CO + O2 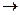 2CO2
2CO2
При окислении двух объемов оксида углерода (II) одним объемом кислорода образуется 2 объема углекислого газа, т.е. объем исходной реакционной смеси уменьшается на 1 объем.
Закон Авогадро - в равных объемах любых газов, взятых при одной и той же температуре и при одинаковом давлении, содержится одно и то же число молекул. Согласно этому закону:
· одно и то же число молекул различных газов при одинаковых условиях занимает одинаковые объемы;
· 1моль любого идеального газа при нормальных условиях (0°C = 273°К , 1 атм = 101,3 кПа) занимает одинаковый объем 22,4 л.
Французский химик А.Л. Лавуазье впервые попытался систематизировать химические элементы в соответствии с их массой. Английский химик Дж.Дальтон ввел понятие атомная масса и явился создателем теории атомного строения. В 1804 году он предложил таблицу относительных атомных масс водорода, азота, углерода, серы и фосфора, приняв за единицу атомную массу водорода. В настоящее время атомная масса измеряется относительно 1/12 массы атома изотопа углерода.
Работу по изучению свойств атомов продолжил Д.И. Менделеев и в 1869 г. сформулировал периодический закон и разработал Периодическую систему химических элементов. Периодический закон был сформулирован в следующем виде: «Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов». В качестве системообразующего фактора Д.И.Менделеев использовал массу химического элемента.В Периодической системе Д.И. Менделеева насчитывалось 62 элемента.
Квантовая механика уточнила, что свойства химических элементов и их соединений определяются зарядом атомного ядра.Современная формулировка периодического закона химических элементов:свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядра атомаи определяются периодически повторяющимися однотипными электронными конфигурациями их атомов.
Реакционная способность атома химического элемента определяется количеством электронов на внешней оболочке атома.
Валентность – свойства атомов одного элемента образовывать определенное число связей с атомами других элементов. Осуществляют химические связи между атомами электроны, расположенные на внешней оболочке и связанные с ядром наименее прочно. Их назвали валентными электронами. Определить валентность (число валентных электронов) можно по таблице Д.И.Менделеева, зная номер группы, в которой находится химический элемент.
Электроотрицательность – свойство атома в соединении притягивать к себе валентные электроны. Чем сильнее атом оттягивает к себе электроны, тем больше его электроотрицательность. Степень окисления - условный заряд, который образуется на атоме, если учесть, что электрон при образовании связи переходит полностью к более электроотрицательному атому. Максимальная степень окисления элемента определяется номером группы в таблице Менделеева.
Атомы в молекулах связаны между собой химическими связями, которые образуются за счет перераспределения валентных электронов между атомами. При образовании химической связи атомы стремятся приобрести устойчивую (завершенную) внешнюю электронную оболочку. Химическая связь – вид фундаментального электромагнитного взаимодействия. Образование химической связи происходит за счет притяжения положительных и отрицательных зарядов, которые образуются на атоме при потере или смещении его электрона со стационарной орбиты. В зависимости от характера взаимодействия атомов различают ковалентную, ионную, металлическую и водородную химические связи.
Ковалентная связь осуществляется за счет образования общих электронных пар между двумя атомами. Она может быть полярной и неполярной. Ионная связь представляет собой электростатическое притяжение между ионами, которые образуются за счет полного смещения электронной пары к одному из атомов. Металлическая связь — это связь между положительными ионами металлов посредством общего электронного облака («электронного газа»).
Кроме внутримолекулярных связей образуются и межмолекулярные связи. Межмолекулярные взаимодействия - взаимодействия молекул между собой, не приводящие к разрыву или образованию внутримолекулярных химических связей. От межмолекулярных взаимодействий зависят агрегатное состояние вещества, структурные, термодинамические, теплофизические и другие свойства веществ. Примером межмолекулярной связи является водородная связь.
Водородная связь - межмолекулярная связь, образованная за счет притяжения более электроотрицательного атома (F, O, N), и атома водорода с частичным положительным зарядом. Например, водородная связь реализуется между молекулами воды, спирта, органических кислот. Она оказывает влияние на температуру кипения вещества.
Водородная связь может образоваться и внутри молекул. Например, внутримолекулярные водородные связи существуют в молекулах нуклеиновых кислот, белков, полипептидов и др. и определяют структуру этих макромолекул
Дата добавления: 2017-01-13; просмотров: 1080;
